[22/11] FDA chấp thuận liệu pháp gen đầu tiên để điều trị bệnh Hemophilia B ở người lớn
Ngày 22/11/2022, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt Hemgenix (etranacogene dezaparvovec), một liệu pháp gen dựa trên vector adenovirus để điều trị cho người lớn mắc bệnh Hemophilia B (thiếu hụt yếu tố đông máu IX bẩm sinh) hiện đang:
- Sử dụng liệu pháp dự phòng yếu tố IX
- Có hoặc từng có tiền sử xuất huyết đe dọa tính mạng
- Có các đợt xuất huyết tự phát nghiêm trọng lặp đi lặp lại.
BỆNH HỌC
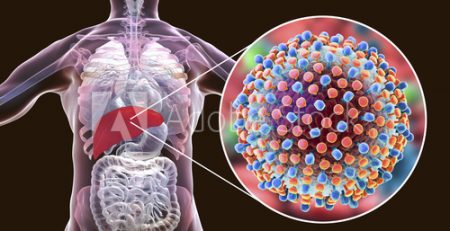
Hemophilia B là một bệnh hiếm gặp đe dọa tính mạng do thiếu hoặc không đủ yếu tố đông máu IX. Tỷ lệ mắc Hemophilia B trong dân số là khoảng 1/40.000.
Những người mắc bệnh này đặc biệt dễ bị chảy máu ở khớp, cơ và các cơ quan nội tạng bao gồm não, dẫn đến đau, sưng và tổn thương khớp. Hầu hết những người mắc bệnh Hemophilia B và có triệu chứng là nam giới. Nhiều phụ nữ mang mầm bệnh không có triệu chứng.
Các phương pháp điều trị hiện tại đối với bệnh Hemophilia B từ trung bình đến nặng bao gồm truyền yếu tố IX dự phòng suốt đời để tạm thời thay thế hoặc bổ sung yếu tố đông máu với liều thấp.
THÔNG TIN THUỐC
Hemgenix là sản phẩm liệu pháp gen chứa vectơ virus AAV5 mang biến thể gen Padua của Yếu tố IX (FIX-Padua) đến các tế bào đích trong gan, tạo ra các protein của yếu tố IX hoạt động mạnh gấp 5-8 lần so với bình thường, nhằm tăng nồng độ yếu tố IX trong máu và do đó hạn chế các đợt xuất huyết.
Không như các phương pháp điều trị hiện tại – bệnh nhân cần tiêm định kỳ (vài lần mỗi tuần) để duy trì đủ lượng yếu tố IX bị thiếu, với Hemgenix, họ chỉ cần truyền tĩnh mạch 1 liều duy nhất.
Nhà sản xuất CSL Behring định giá 3,5 triệu đô la cho mỗi liều Hemgenix, khiến nó trở thành loại thuốc đắt nhất thế giới.
DỮ LIỆU NGHIÊN CỨU
Tính an toàn và hiệu quả của Hemgenix đã được đánh giá trong nghiên cứu HOPE-B (pha III, đơn nhánh, đa quốc gia, nhãn mở). Tổng cộng có 54 bệnh nhân được dùng một liều HEMGENIX duy nhất, với 53 bệnh nhân hoàn thành ít nhất 18 tháng theo dõi.
Tiêu chí đánh giá chính là ABR – tỷ lệ chảy máu hàng năm. Tiêu chí phụ bao gồm đánh giá hoạt động của yếu tố IX.
Kết quả cho thấy các đối tượng đã tăng mức độ hoạt động của yếu tố IX, giảm nhu cầu điều trị dự phòng thay thế yếu tố IX thông thường và giảm 54% ABR so với ban đầu.
TÁC DỤNG PHỤ
Các phản ứng bất lợi phổ biến nhất bao gồm tăng men gan, nhức đầu, phản ứng nhẹ liên quan đến truyền dịch và các triệu chứng giống cúm. Bệnh nhân nên được theo dõi các phản ứng truyền dịch bất lợi và tăng men gan (viêm gan) trong máu.
Không có phản ứng bất lợi nghiêm trọng được báo cáo.
Biên dịch: Lâm Trịnh Diễm Ngọc
Tài liệu tham khảo:
- https://www.fda.gov/news-events/press-announcements/fda-approves-first-gene-therapy-treat-adults-hemophilia-b?fbclid=IwAR1FJT9qCi2GVDxRdMxM_SjF8AH3PRlZqBQZAKHV1p2gKLPG_t-q60C4Crk
- https://www.cslbehring.com/newsroom/2022/fda-hemgenix?fbclid=IwAR1FJT9qCi2GVDxRdMxM_SjF8AH3PRlZqBQZAKHV1p2gKLPG_t-q60C4Crk
- https://edition.cnn.com/2022/11/23/health/hemophilia-drug-hemgenix/index.html