Cuộc chiến chống nấm
Biên dịch: Nguyễn Thái Minh Trận
Hiệu đính: TS: Võ Đức Duy
Trong khi tình trạng nhiễm nấm toàn thân (systemic fungal infections) có thể dẫn đến tử vong đang ngày càng gia tăng, thì các loại thuốc dùng để điều trị chúng lại đang ngày càng tỏ ra kém hiệu quả. Lo ngại về vấn đề này, các nhà khoa học đã chung tay tìm kiếm những cách thức mới để chống lại sự lây nhiễm của nấm.
Kẻ thù vô hình
Nấm xuất hiện ở xung quanh chúng ta. Chúng có thể sống trong đất, cũng có thể phát triển trên cơ thể chúng ta. Chúng tạo ra hàng triệu bào tử mà chúng ta hít vào và thở ra trong từng nhịp thở. Trong số hàng triệu loại nấm, chỉ có vài trăm loại có thể lây nhiễm sang người. Và những người có hệ thống miễn dịch khỏe mạnh sẽ dễ dàng chống lại sự lây nhiễm này, điều này làm cho nhiễm nấm toàn thân thường rất hiếm. Tuy nhiên, khi chúng thực sự tấn công được, nhiễm nấm toàn thân sẽ trở nên đặc biệt nguy hiểm, chúng có thể tấn công các cơ quan nội tạng, bao gồm não, tim và phổi. Theo ghi nhận của Quỹ Hành động Toàn cầu về Nhiễm nấm (GAFFI), nhiễm nấm toàn thân có tỷ lệ tử vong cao bất thường, khoảng 15 đến 50%, và giết chết hơn 1 triệu người mỗi năm.
Nhiễm nấm có xu hướng tấn công những người có hệ thống miễn dịch bị tổn thương. Và thực tế, nhóm người này đang ngày càng phổ biến trong các thập kỷ gần đây. Điều này là bởi vì càng ngày càng có nhiều loại thuốc giúp con người kéo dài sự sống, nhưng cái giá phải trả chính là sự suy yếu của hệ thống miễn dịch. Những loại thuốc này thường bao gồm một số liệu pháp hóa trị ung thư và thuốc ngăn cơ thể từ chối cấy ghép nội tạng.
Để điều trị nhiễm nấm, hiện nay các bác sĩ chỉ có bốn loại thuốc ít ỏi để lựa chọn, và nấm đã trở nên nhanh chóng kháng lại tất cả chúng. Chúng ta đang ngày càng mở rộng nhóm bệnh nhân có nguy cơ mắc bệnh nhiễm nấm, nhưng lại không làm được gì để cải thiện các hệ quả mà chúng đem lại. Trong 40 năm qua, không có một mảng y học nào đạt được ít tiến bộ hơn mảng điều trị các bệnh nhiễm do nấm.
Khan hiếm thuốc điều trị
Đã 20 năm kể từ khi nhóm thuốc Echinocandins được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) chấp thuận năm 2001, nâng tổng số nhóm thuốc điều trị nấm được FDA chấp thuận lên bốn – tất cả chúng đều có nhược điểm (Hình 1).
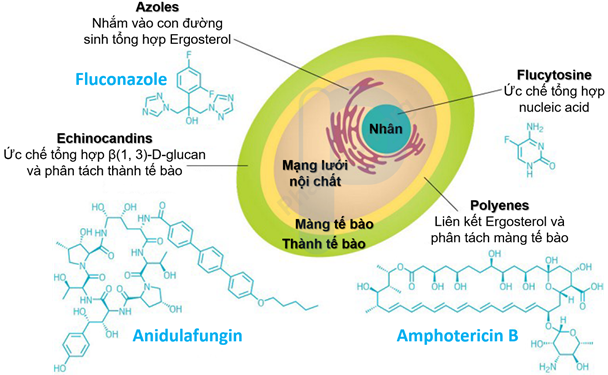
Hình 1: Bốn loại nhóm thuốc điều trị nhiễm nấm đã được FDA phê duyệt và vị trí mục tiêu của chúng
Nguồn: Antibiotics 2020, DOI: 10.3390/antibiotics9080445
Echinocandin ức chế enzyme tổng hợp β-glucan, một thành phần thiết yếu của thành tế bào nấm. Tế bào của con người không có thành tế bào, do đó, enzyme này là một mục tiêu hấp dẫn. Tuy nhiên, một số loại nấm, bao gồm Cryptococcus, đã cho thấy khả năng kháng lại Echinocandin. Cryptococcus là một loại nấm thường lây nhiễm cho những người không được điều trị HIV, và đã giết chết khoảng 125.000 người mỗi năm, theo GAFFI. Echinocandin phải được tiêm tĩnh mạch, có nghĩa là chúng phải được tiêm tại phòng khám hoặc bệnh viện. Từ đó, hạn chế khả năng sử dụng rộng rãi của nhóm thuốc này.
Polyenes, là nhóm thuốc chống nấm lâu đời nhất, cũng được tiêm tĩnh mạch. Những loại thuốc này, được biết đến nhiều nhất là Amphotericin B, đã có từ những năm 1950. Chúng tiêu diệt nấm bằng cách liên kết với Ergosterol, một loại sterol trong màng tế bào nấm. Điều này làm phân tách Ergosterol và để lại các lỗ thủng trên màng, dẫn đến tăng tính thấm trên màng đủ để nấm bị rò rỉ đến chết. Tuy nhiên, Polyenes cũng tương tác với Cholesterol trong màng tế bào của con người, có thể gây ra các tác dụng phụ gây chết người. Tác dụng phụ gây nhiễm độc thận của Amphotericin B khét tiếng đến mức các bác sĩ thường gọi loại thuốc này là “Nỗi khiếp đảm Amphotericin B.”
Azoles là nhóm thuốc chống nấm duy nhất trên thị trường có thể được dùng dưới dạng thuốc viên. Nhóm thuốc này cũng phân tách Ergosterol, nhưng thay vì tương tác trực tiếp với sterol, chúng lại khóa các enzyme phụ thuộc cytochrome P450 (cytochrome P450–dependent enzyme) của nấm liên quan đến việc tạo Ergosterol, cuối cùng làm ảnh hưởng đến tính toàn vẹn của màng tế bào nấm. Tuy nhiên, con người cũng có vô số enzyme phụ thuộc cytochrome P450, và việc ức chế các Enzyme này thường dẫn đến nhiễm độc gan.
Nhóm thuốc cuối cùng là Fluorocytosine, được sử dụng bằng đường uống và tiêm tĩnh mạch. Hợp chất này ức chế sự tổng hợp DNA và RNA của nấm, làm rối loạn việc tạo ra một số protein thiết yếu. Tuy nhiên, nấm lại kháng lại nó nhanh đến mức nó hầu như không bao giờ được sử dụng một mình.
Nhiều loại thuốc ngăn chặn sự phát triển của nấm thay vì giết chết chúng. Điều này đồng nghĩa với việc chúng ta đang thực sự cung cấp nhiều lựa chọn phong phú để nấm phát triển sức đề kháng. Với quá ít loại thuốc, các bác sĩ đã lo ngại về sự gia tăng số lượng trường hợp nhiễm nấm kháng thuốc – cả ở người khỏe mạnh cũng như người bệnh.
Việc tạo ra một hợp chất chống nấm hoạt động tốt là rất khó vì người và nấm có quan hệ mật thiết với nhau. Cả hai đều là sinh vật nhân thực và chia sẻ nhiều con đường sinh học giống nhau. Chúng ta có thể dễ dàng tìm thấy các hợp chất chống nấm, vấn đề là chúng sẽ giết chết bệnh nhân trước khi nấm được loại bỏ. Việc khai thác một số điểm khác biệt giữa người và nấm để phát triển thuốc chống nấm cũng đã được thực hiện, chẳng hạn như nấm có thành tế bào, trong khi tế bào người thì không, hay màng tế bào nấm chứa Ergosterol, trong khi màng tế bào người sử dụng Cholesterol. Tuy nhiên, những khác biệt này thường rất nhỏ và thực sự không có nhiều mục tiêu lựa chọn mà có thể khai thác từ góc nhìn phát triển thuốc chống nấm. Đây cũng là lý do chính giải thích cho việc tại sao kho vũ khí thuốc điều trị nhiễm nấm mà chúng ta hiện có vẫn còn rất ít.
Nếu muốn cải thiện kho vũ khí này cũng như khắc phục tình trạng kháng thuốc, chúng ta cần phải tìm kiếm các mục tiêu mới. Nên có các loại thuốc với một số cơ chế hoạt động khác nhau, được sử dụng trong dự phòng hoặc điều trị, hoặc cả hai, để điều trị các bệnh nhiễm nấm.
Ứng viên thuốc mới
Gwt1 là enzyme nằm trong lưới nội chất có liên quan đến việc gắn các Mannoprotein vào thành tế bào nấm. Mannoprotein đóng vai trò như lớp áo giáp cho tế bào nấm. Nếu không có chúng, nấm không thể xâm nhập các cơ quan và trở nên nhạy cảm với hệ thống miễn dịch của vật chủ. Vì lý do này mà Gwt1 đã được các nhà khoa học quan tâm như một mục tiêu chống nấm trong nhiều thập kỷ. Tuy nhiên, bước ngoặt chỉ thực sự xuất hiện trong những năm gần đây khi thuốc Fosmanogepix của Công ty Dược phẩm Amplyx, Mỹ được đưa vào thử nghiệm lâm sàng (Hình 2).
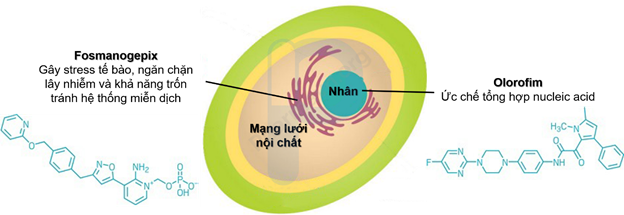
Hình 2: Cấu trúc hóa học và tác dụng của Olorofim và Fosmanogepix
Fosmanogepix là tiền chất có nhóm N-phosphonooxymethylene được phân cắt bởi các enzym phosphatase. Nó là một phân tử nhỏ có thể ức chế Gwt1, khiến Mannoprotein mắc kẹt bên trong lưới nội chất, gây stress tế bào nấm. Đồng thời, bề mặt tế bào nấm sẽ bị thiếu Mannoprotein, làm thành tế bào yếu đến mức nấm không còn khả năng lây nhiễm sang các tế bào khác hoặc trốn tránh hệ thống miễn dịch của vật chủ. Fosmanogepix có thể sử dụng theo đường uống hoặc tiêm tĩnh mạch. Trong các thí nghiệm trên tế bào và động vật, nó không cho thấy bất kỳ hoạt động nào ức chế Gwt1 ở động vật có vú. Nó cũng đã hoàn thành thử nghiệm lâm sàng giai đoạn 2 đối với nhiễm nấm Candida Albicans xâm lấn và đang trong giai đoạn 2 đối với điều trị các loại nhiễm nấm khác, bao gồm cả nhiễm do nấm Candida auris. Ngoài các thử nghiệm lâm sàng giai đoạn 2 đang diễn ra của Fosmanogepix, Công ty Dược phẩm Amplyx cũng đang khám phá các liệu pháp kháng nấm khác dựa trên cơ chế hoạt động tương tự.
Một mục tiêu chống nấm khác cũng khiến các nhà khoa học quan tâm đó là Dihydroorotate Dehydrogenase (DHODH), là enzyme tham gia vào quá trình sinh tổng hợp Pyrimidine, một thành phần quan trọng trong tổng hợp DNA và RNA. Hợp chất đầu tiên để ức chế DHODH là Olorofim của Công ty F2G, Anh (Hình 2). Olorofim ngăn chặn DHODH ở nấm làm gián đoạn quá trình tổng hợp DNA và RNA, khiến nấm ngừng phát triển, sưng lên và vỡ ra. Tuy nhiên, Olorofim chỉ tiêu diệt được một số loại nấm, đáng chú ý nhất là Aspergillus, có liên quan đến khoảng 200.000 ca nhiễm nấm hàng năm. Nó cũng đã được chứng minh là có thể tiêu diệt nấm gây bệnh Sốt thung lũng (Valley fever), một căn bệnh có thể ảnh hưởng đến não và khó điều trị. Olorofim có tính chọn lọc đối với DHODH ở nấm gấp 2.200 lần so với DHODH ở người. Nó có thể được sử dụng bằng đường uống. Do đó, bệnh nhân không cần phải đến bệnh viện để được điều trị. Hợp chất này có thể được sử dụng như một biện pháp bảo vệ cho nhóm người dễ bị nhiễm nấm như những người đang hóa trị cho một số bệnh ung thư. Công ty F2G dự kiến sẽ cho Olorofim bắt đầu thử nghiệm Giai đoạn 3 đối với bệnh nhiễm nấm Aspergillus xâm lấn vào cuối năm nay.
Mục tiêu cũ, cách thức mới
Các nhà khoa học cũng đang xem xét những cách thức mới để tiếp cận các mục tiêu enzyme cũ bằng các ứng viên thuốc mới (Hình 3 và 4).
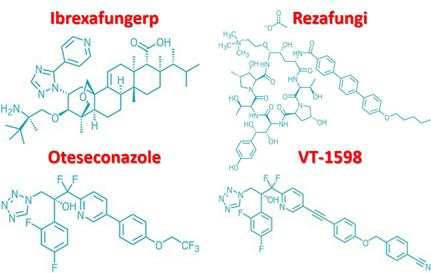
Hình 3: Cấu trúc hóa học của Ibrexafungerp, Rezafungi, Oteseconazole và VT-1598
Tại công ty Scynexis, Mỹ, các nhà nghiên cứu đang tìm hiểu Ibrexafungerp, một hợp chất ức chế cùng một loại enzyme mà Echinocandin ức chế nhưng có một cấu trúc hoàn toàn khác. Ibrexafungerp là một dẫn xuất của Enfumafungin, một hợp chất có hoạt tính kháng nấm nhưng được chuyển hóa quá nhanh nên không hiệu quả. Phối hợp với Công ty dược phẩm Merck & Co., Mỹ, các nhà nghiên cứu của Scynexis đã sửa đổi cấu trúc Enfumafungin để tạo ra một phân tử ổn định hơn và có thể được đưa vào cơ thể bằng cả đường uống và đường tiêm tĩnh mạch. Các thử nghiệm lâm sàng giai đoạn 3 cho điều trị nhiễm nấm toàn thân, bao gồm cả nấm Candida auris, đang được tiến hành và FDA đang xem xét liệu có nên chấp thuận Ibrexafungerp để điều trị nhiễm nấm âm đạo.
Công ty Cidara Therapeutics, Mỹ đang khám phá các dẫn xuất của Echinocandin. Rezafungin ứng cử viên lâm sàng của công ty là một dẫn xuất của Anidulafungin, là một Echinocandin bán tổng hợp. Các nhà hóa học đã đặt một nhóm choline tại một điểm quan trọng trên Rezafungin, một tính năng giúp ổn định vòng Echinocandin và ngăn ngừa sự phân hủy trao đổi chất của phân tử. Điều này cho phép Rezafungin được sử dụng một lần một tuần so với phải tiêm tĩnh mạch hằng ngày của Echinocandin hiện có, vốn phải được sử dụng trong bệnh viện. Rezafungin đang được thử nghiệm lâm sàng giai đoạn 3. Nếu thuốc được chấp thuận, bệnh nhân có thể được điều trị ngoại trú bằng cách đến gặp bác sĩ để được truyền dịch hàng tuần.
Các nhà khoa học cũng đang nghiên cứu để cải thiện các hợp chất dựa trên Azole. Chẳng hạn như Công ty dược phẩm Mycovia, Mỹ đang phát triển các hợp chất có hiệu nghiệm lớn hơn và ít tác dụng phụ hơn so với các chất Azoles hiện được chấp thuận để điều trị nhiễm nấm. Trong khi các Azoles trên thị trường có nhóm Imidazole hoặc Triazole thì các ứng cử viên thuốc của Mycovia là Oteseconazole và VT-1598 có nhóm Tetrazole. Chúng được thiết kế để liên kết chặt chẽ với Cytochrom P450 của nấm nhưng không liên kết với enzym Cytochrom P450 của người, là nguyên nhân gây ra tác dụng phụ của thuốc chống nấm Azole. Oteseconazole gần đây đã hoàn thành các thử nghiệm lâm sàng giai đoạn 3 đối với nhiễm nấm âm đạo mãn tính. Công ty Mycovia đang có kế hoạch nộp đơn đăng ký thuốc mới cho hợp chất này với FDA trong năm nay. VT-1598 đang trong thử nghiệm lâm sàng giai đoạn 1 đối với một số loại nhiễm nấm xâm lấn.

Hình 4: Cơ chế hoạt động của các nhóm thuốc chống nấm
Nguồn: J Fungi 2020, DOI: 10.3390/jof6010028
Các thách thức phải đối mặt
Trong khi các bác sĩ và nhà khoa học đang háo hức chờ đợi nhiều loại thuốc chống nấm được chấp thuận hơn, thì các công ty dược phẩm đã lưu ý rằng việc có được một loại thuốc kháng nấm thông qua các thử nghiệm lâm sàng là rất khó khăn và không đảm bảo thành công về mặt thương mại.
Một trong những thách thức lớn nhất đối với các thử nghiệm lâm sàng về thuốc kháng nấm là những người bị nhiễm nấm vốn dĩ đã ốm quá nặng. Họ thường mang nhiều căn bệnh tiềm ẩn do trải qua các đợt điều trị kéo dài và phải nằm trong phòng chăm sóc đặc biệt của bệnh viện. Vì vậy, khó có thể phân biệt được liệu một bệnh nhân chết là do thuốc không có tác dụng kháng nấm hay là do căn bệnh tiềm ẩn đã phát triển quá nặng. Bên cạnh đó, vì bệnh nhân quá ốm nên việc nhận được sự đồng ý của họ để đăng ký thử nghiệm lâm sàng thường rất khó khăn. Ngoài ra, các bác sĩ thường cho bệnh nhân sử dụng thuốc kháng nấm đã được phê duyệt ngay khi họ nghi ngờ bệnh nhân bị nhiễm nấm vì việc trì hoãn điều trị kháng nấm có thể khiến bệnh nhân tăng nguy cơ tử vong. Tuy nhiên, việc thử nghiệm một loại thuốc kháng nấm mới sau khi bệnh nhân sử dụng một loại thuốc đã được phê duyệt trước đó sẽ cho kết quả thiếu chính xác. Thêm nữa, phải mất khoảng 72 giờ để nuôi cấy nấm từ máu. Và cần kết quả của môi trường nuôi cấy đó để đăng ký một người vào thử nghiệm lâm sàng. Kết quả là phải đăng ký một bệnh nhân vào thử nghiệm lâm sàng vào cùng ngày mà kết quả cấy máu cho kết quả dương tính. Điều này là một thách thức về mặt hậu cần nhưng cũng có nghĩa là ứng cử viên thuốc đang được thử nghiệm muộn trong quá trình lây nhiễm.
Yếu tố thương mại cũng kìm hãm sự phát triển của thuốc chống nấm do nhiều nhà đầu tư và công ty không thấy nó mang lại lợi nhuận. Chỉ có một số lượng tương đối nhỏ người cần thuốc kháng nấm và họ thường chỉ dùng thuốc trong một thời gian ngắn, điều này giới hạn số tiền mà một công ty có thể kiếm được.
Nếu không có những nguồn tài trợ, các nhà khoa học lo lắng rằng việc phát triển thuốc chống nấm sẽ không phải là một ưu tiên hàng đầu. Theo Tiến sĩ Dược sĩ Lopez-Ribot tại Đại học Texas, San Antonio: “Đối với chúng tôi, những người đã tham gia vào lĩnh vực bệnh truyền nhiễm, bạn sẽ cảm thấy rằng chúng tôi là những người ít được chú ý”. Ông tự hỏi rằng Liệu đại dịch COVID-19 có thể khiến các công ty dược phẩm, cơ quan tài trợ và công chúng nghĩ lại và đầu tư thêm vào phát triển các liệu pháp điều trị bệnh truyền nhiễm, bao gồm cả nhiễm nấm, hay không? Ông nói: “Chúng ta có cảm giác sai lầm rằng chúng ta đã chiến thắng bệnh truyền nhiễm với kỷ nguyên kháng sinh. Tuy nhiên, đại dịch này lại đang nhắc nhở chúng ta rằng bệnh truyền nhiễm là loại bệnh thực sự có thể quét sạch tất cả.”
Tài liệu tham khảo
Bethany Halford, The fight against fungi, Chemical & Engineering News. Cited April 1st, 2021. https://cen.acs.org/pharmaceuticals/drug-discovery/fight-against-fungi-antifungal/99/i7