Đồng hồ hẹn giờ cho khối u tế bào B
Biên dịch: Đặng Thị Trâm
Các thay đổi đặc hiệu khối u trong methyl hóa DNA thu được chủ động qua các quá trình phiên mã và thụ động bằng tích lũy qua thời gian. Phân tích thông qua u ác tính tế bào B hiện nay cho thấy những thay đổi này cung cấp cái nhìn vào nguồn gốc tế bào cũng như lịch sử quá trình tăng sinh khối u, từ đó có giá trị phân tích và chẩn đoán.
Các tế bào B trải qua một quá trình phức tạp gồm nhiều bước biệt hóa được điều khiển ở mức độ phân tử thông qua những thay đổi ngoại di truyền mạnh mẽ, bao gồm methyl hóa DNA, từ đó kiểm soát các chương trình biểu hiện gene điều khiển các quyết định số phận tế bào, sự tăng sinh và sự sống còn. Mất điều hòa các chương trình này bởi các đột biến somatic và các tác nhân khác có thể dẫn đến sự biến đổi của tế bào B ở các giai đoạn khác nhau của quá trình biệt hóa, dẫn đến các bệnh ác tính. Sự methyl hóa DNA của u ác tính tế bào B là một sản phẩm của những thay đổi chủ động liên hệ với sự biệt hóa và thụ động không liên hệ với biểu hiện gene và phần nào đó liên hệ với nguyên phân và từ đó có thể dẫn đến cấu trúc trạng thái biệt hóa và lịch sử tăng sinh của khối u cũng như bao gồm những thay đổi đặc hiệu khối u khác. Trong chủ đề này của Nature Cancer, Duran-Ferrer và cộng sự đã trình bày phân tích về dấu ấn methyl hóa DNA của 1,595 mẫu của phổ bệnh ác tính tế bào B cho thấy những thay đổi trong methyl hóa DNA có ý nghĩa phân tích và chẩn đoán.
Thông qua phân tích dữ liệu mật độ cao, trạng thái methyl hóa của 88% CpG phân tích được xác định là không bền trong u ác tính tế bào B, tương ứng với 25% thay đổi liên quan với sự biệt hóa tế bào B bình thường, phản ánh sự liên hệ các bệnh riêng biệt với nguồn gốc tế bào khác nhau. 63% các vùng CpG bổ sung là thay đổi trong một bệnh cụ thể so sánh với các vùng CpG trong các vùng tế bào B bình thường. Sự thay đổi này có thể được khai thác cho thấy vai trò của methyl hóa DNA trong sinh học của loại u này. Hơn nữa, 94 gene với kiểu đặc hiệu bệnh với sự giảm methyl hóa DNA đã được cho thấy có sự thay đổi tương ứng trong biểu hiện gene.
Các vùng biệt hóa khác nhau có liên quan đến các tiểu phần điều hòa và các thể gen thể hiện chỉ một phần nhỏ các thay đổi bệnh đặc hiệu trong methyl hóa. Ngoài ra, mỗi u ác tính tế bào B có thể được phân loại nhỏ hơn ở trong các kiểu nhỏ phân tử. Duran-Ferrer và cộng sự từ đó đã tận dụng nguồn dữ liệu lớn này để cấu trúc cây phân loại hai bước có thể phân biệt giữa các bệnh (ALL, MCL, CLL, DLBCL hay MM) và các phân lớp nhỏ hơn di truyền tế bào của ALL, các phân lớp ngoại di truyền của MCL (phân lớp 1 hay phân lớp 2) và CLL (low programmed, intermediate programmed or high programmed), và các kiểu nhỏ phiên mã của DLBCL (activated B cell–like (ABC-like) hoặc germinal-center B cell–like (GCB like) DLBCL) được xác định trên nền tảng của các tập hợp nhỏ của chỉ thị sinh học CpG.
Sự thay đổi chủ yếu trong methyl hóa DNA không liên hệ trực tiếp đến những thay đổi trong biểu hiện gene và có khả năng thu được thụ động hoặc liên hệ đến các quá trình vẫn chưa được xác định. Duran-Ferrer và cộng sự đã xác định các mô hình bệnh đặc hiệu của methyl hóa DNA quá mức và giảm methyl hóa DNA bằng cách kiểm tra các sự thay đổi liên quan đến các tế bào gốc tạo máu. Điều này giúp cung cấp một dấu ấn phổ biến cho tất cả u tế bào B và giúp xác định 4 loại thay đổi methyl hóa liên hệ với các thay đổi trong sự biệt hóa tế bào B hoặc các thay đổi đặc hiệu khối u. Những thay đổi này được xác định chủ yếu ở trong các vùng nhiễm sắc câm (silent) và điều này không liên hệ với phiên mã. Những thay đổi methyl hóa DNA này được tích lũy trong suốt quá trình phân bào và theo đó những kiểu hình thu được có nguồn gốc từ đồng hồ nguyên phân dựa trên sự methyl hóa. Duran-Ferrer và cộng sự ban đầu đã sử dụng dữ liệu thu được bằng kết tủa miễn dịch chất nhiễm sắc được theo dõi bởi phân tích trình tự chuyên sâu để xác định các vùng quan tâm tạo thành trạng thái im lặng và/hoặc được đánh dấu với H3K27me3 biến đổi histone được kiểm soát, và sau đó tích hợp chúng với dữ liệu methyl hóa DNA từ các tế bào gốc tạo máu người và các tế bào huyết thanh có nguồn gốc tủy xương để xác định các vùng CpG đã thay đổi trạng thái methyl hóa giữa các tế bào với lịch sử tăng sinh thấp nhất (các tế bào gốc tạo máu) và cao nhất (các tế bào huyết thanh có nguồn gốc tủy xương). Chúng được sử dụng để tạo hai ‘đồng hồ’ của epiCMIT: một gây ra methyl hóa quá mức và một làm giảm methyl hóa. Đồng hồ với giá trị lớn nhất được sử dụng như giá trị epiCMIT cho mỗi khối u, từ đó có thể thu giữ các khuynh hướng biệt hóa dẫn đến tạo ra hay làm mất methyl hóa, phát hiện lịch sử tăng sinh của một khối u đặc biệt, liên hệ đến khả năng tăng sinh tại thời điểm phân tích và là một yếu tố chẩn đoán độc lập mạnh trong các bệnh nhân ALL, CLL hay MCL.
Những dữ liệu phân tích trạng thái methyl hóa CpG đã ủng hộ vai trò của các thay đổi chủ động thu được trong methyl hóa DNA, nhắm tới các phần tử điều hòa và các thể gene trong mối liên hệ với tín hiệu và chuyển dịch tế bào, đối với nguồn gốc của các u ác tính tế bào B khác nhau. Tuy nhiên, các hiểu biết xa hơn về điều hòa methyl hóa DNA, và ý nghĩa của chúng trong sinh học về bệnh, sẽ đòi hỏi sự kết hợp các kiểu hình methyl hóa DNA với các phương pháp khối u kết hợp của các chỉ thị ngoại di truyền khác, chẳng hạn các biến thể histone hậu dịch mã.
Phân loại nhỏ hơn các u ác tính tế bào B có thể có lợi trong trường hợp các đặc điểm có chung ở các bệnh có thể gây khó khăn cho chẩn đoán phân loại, chẳng hạn CLL và MCL, hay trong các phân lớp của các kiểu nhỏ phân tử phức tạp hơn, như các kiểu nhỏ của ABC-like và GCB-like của DLBCL. Hơn nữa, mặc dù cách tiếp cận này đạt được thành công trong phân biệt giữa các kiểu nhỏ di truyền học tế bào của B-ALL, những kiểu nhỏ này cũng có các kiểu hình phiên mã khác biệt. Do đó, không chắc chắn là liệu các tín hiệu methyl hóa DNA có thể hữu ích cho các kiểu nhỏ được xác định bởi các cấu trúc di truyền phức tạp hơn không đi kèm với các kiểu hình phiên mã mạnh, như các kiểu nhỏ di truyền được mô tả gần đây của DLBCL. Nếu hữu ích, các tín hiệu methyl hóa DNA có thể là một cách tiếp cận hợp lí hơn cho phân loại các kiểu nhỏ phân tử phức tạp và các trường hợp vẫn chưa được phân loại bằng di truyền học đơn lẻ.
Trong CLL, epiCMIT liên quan đến sự hiện diện của các thay đổi di truyền, cho thấy các dấu ấn tăng sinh dựa trên methyl hóa là quan trọng, có thể mang lại một công cụ chẩn đoán có thể được ứng dụng rộng rãi với u ác tính tế bào B, nhưng nó vẫn yêu cầu sự thẩm định trong các kiểu nhỏ như DLBCL, u lympho thể nang và u lympho tế bào B có độ ác tính cao, đối với các dữ liệu chưa có sẵn trong nghiên cứu này. Ngoài ra, những cải tiến gần đây đã cho phép khám phá các kiểu mẫu methyl hóa DNA đặc hiệu khối u trong các phân đoạn DNA tự do (cell-free DNA) trong máu ngoại vi. Từ đó, các tín hiệu được mô tả trong nghiên cứu này có thể được sử dụng như một bước đầu quan trọng cho sự phát triển tương lai của các phương pháp phân tích và chẩn đoán phần tử nhỏ không xâm lấn sử dụng các mô hình methyl hóa DNA tự do ở các bệnh nhân u ác tính tế bào B.
Các tín hiệu của methyl hóa quá mức và sự khử methyl hóa trong các khối u có khả năng phân loại chính xác các thực thể bệnh cũng như phân loại rõ hơn các kiểu phụ và được tận dụng để phát triển một ‘đồng hồ’ methyl hóa DNA dựa trên nguyên phân, quá trình nguyên phân tích lũy phát hiện ngoại di truyền (epigenetically determined cumulative mitoses, epiCMIT) (hình 1) cho thấy giá trị chẩn đoán độc lập trong các u tế bào B ác tính khác nhau bởi sự lưu giữ lịch sử tăng sinh của các tế bào khối u.
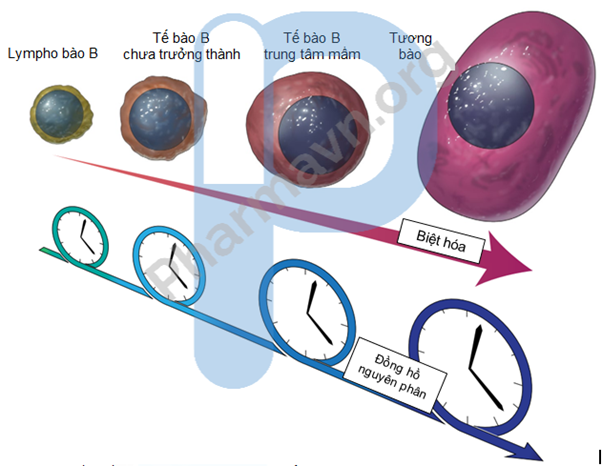
Hình 1: Đồng hồ epiCMIT, epiCMIT thu giữ các điểm đọc dựa trên methyl hóa DNA của lịch sử phân bào liên hệ với sự biệt hóa tế bào B bình thường và sự tăng sinh của các tế bào B u ác tính để phát triển một phương pháp chẩn đoán dựa trên quá trình nguyên phân. Sự tham gia của biệt hóa tế bào B bình thường đến các thay đổi methyl hóa có nghĩa là u ác tính có liên kết đến các counterpart bình thường khác nhau (ví dụ, B-ALL với lympho bào B (B cell progenitor), CLL với các tế bào B chưa trưởng thành (naive B cells), DLBCL với các tế bào B trung tâm mầm, và MM với tương bào) có các dấu ấn có nguồn gốc epiCMIT đặc biệt có thể chỉ so sánh với các khối u có trạng thái trưởng thành tương tự.
Duran-Ferrer và cộng sự đã cung cấp cái nhìn quan trọng về cơ chế của sự thay đổi methyl hóa DNA trong u ác tính tế bào B, cũng như ý nghĩa phân tích và chẩn đoán của chúng. Những phát hiện này cho thấy tiềm năng ứng dụng methyl hóa DNA như một chỉ thị sinh học có ý nghĩa lâm sàng cho các bệnh u ác tính tế bào B. Mặc dù nó vượt quá phạm vi của nghiên cứu gần đây, các kiểu hình có thể hoạt động (actionable phenotypes) có thể được liên kết với các tín hiệu methyl hóa DNA có khả năng sử dụng như các chỉ thị sinh học cho các liệu pháp trong tương lai.
Tài liệu tham khảo:
A ticking clock for B cell tumors. Nature Cancer 2020, 1035. https://www.nature.com/articles/s43018-020-00132-1
Hình đại diện từ: https://hscnews.usc.edu/cancer-has-a-biological-clock-and-this-drug-may-keep-it-from-ticking