Đột phá trong điều trị bệnh Herpes với kỹ thuật chỉnh sửa gene
Tác giả: Trần Thị Quỳnh Hoa, Võ Phạm Thủy Tiên, Nguyễn Thái Minh Trận
Mentor: Võ Đức Duy, Ph.D.
Mới đây, các nhà nghiên cứu tại Viện Ung thư Fred Hutchinson, Mỹ đã sử dụng công cụ chỉnh sửa gen Meganuclease kết hợp với phương tiện vận chuyển Adeno-Associated Virus để loại bỏ lên tới 90% virus Herpes Simplex loại 1 tiềm ẩn trong mô hình vật chủ chuột thí nghiệm, một mức độ đủ để các nhà nghiên cứu tin rằng nó sẽ ngăn chặn khả năng hoạt động trở lại của loại virus này.
Herpes – Nỗi ám ảnh vẫn chưa có phương pháp chữa trị triệt để
Herpes, còn được gọi là mụn rộp, là một căn bệnh truyền nhiễm siêu phổ biến được gây ra bởi virus Herpex Simplex loại I (HSV-1) hoặc virus Herpex Simplex loại II (HSV-2). Cả 2 loại virus này đều gây ra các triệu chứng chung là các mụn rộp rỉ nước, gây lở loét, đau đớn ở trên nhiều vị trí cơ thể của người bệnh, lây lan thông qua tiếp xúc da kề da với vùng bị nhiễm, thường là qua việc tiếp xúc môi kề môi hoặc qua con đường tình dục với người đã bị nhiễm Herpes trước đó. Nếu vùng xuất hiện mụn rộp là trong hoặc xung quanh miệng, môi hoặc cổ họng, thì sẽ được gọi là Herpes miệng, còn nếu vùng bị nhiễm là trên hoặc xung quanh bộ phận sinh dục, bao gồm âm hộ, âm đạo, cổ tử cung, hậu môn, dương vật, bìu dái, mông hoặc đùi trong, thì sẽ được gọi là Herpes sinh dục. Ngoài ra, ở một số ít người, HSV còn có thể lây nhiễm vào bên trong mắt hoặc não, dẫn đến các hậu quả rất tàn khốc, như mù lòa hoặc viêm não (Hình 1, Bảng 1) [1].

Hình 1: Triệu chứng của bệnh Herpes. A) Herpes miệng; B) Herpes sinh dục; C) Viêm giác mạc do Herpes
Đặc trưng nổi bật nhất của Herpes nằm ở việc Herpes là căn bệnh xã hội phổ biến (người nhiễm bệnh có thể lây lan ngay cả khi không hề xuất hiện triệu chứng) nhưng tới hiện tại vẫn chưa hoàn toàn có một phương pháp chữa trị triệt để. Điều này đồng nghĩa với việc, một khi đã bị nhiễm Herpes, người bệnh phải sống với nó suốt phần đời còn lại. Ban đầu, HSV sẽ xâm nhập vào cơ thể thông qua niêm mạc vùng miệng hoặc vùng sinh dục để tới biểu mô vảy xếp lớn (stratified squamous epithelium) nơi chúng bắt đầu nhân bản chính mình. Sau đó, chúng sẽ bị hấp thụ bởi các dây thần kinh cảm giác phân nhánh không được myelin bao quanh (ramifying unmyelinated sensory nerve fibers) nằm ở bên trong các biểu mô vảy xếp lớn này, trước khi chúng được vận chuyển ngược dòng thông qua vi ống để tới các tế bào hạch dây thần kinh sinh ba (trigeminal ganglia) nằm ở gần tai (đối với HSV-1) hoặc hạch rễ lưng (dorsal root ganglion) nằm ở tủy sống (đối với HSV-2), nơi chúng thiết lập nơi ẩn náu suốt đời. Phần lớn thời gian, virus sẽ nằm ở trạng thái ngủ đông (dormant) trong các tế bào thần kinh này. Chỉ khi có các tác nhân kích thích (như sốt, căng thẳng, kinh nguyệt hay ức chế miễn dịch) hoặc theo định kỳ (trung bình từ 2 đến 7 lần một năm), HSV sẽ bắt đầu tái hoạt động, di chuyển thuận chiều theo vi ống để quay trở lại các biểu mô vảy xếp lớn (thường là vùng da bị nhiễm ban đầu), nơi chúng bắt đầu nhân lên và đi vào dịch tiết ở miệng hoặc bộ phận sinh dục (Hình 2) [2]. Quá trình này có thể dẫn đến xuất hiện các triệu chứng lâm sàng như mụn rộp rỉ nước, gây lở loét, đau đớn cho người bệnh. Thông thường, sau khoảng 2 đến 3 tuần, hệ miễn dịch của chúng ta sẽ tiêu diệt các đợt bùng phát mụn rộp này, các vết loét sau đó sẽ bắt đầu đóng vảy, tự lành lại và biến mất. Tuy nhiên, virus vẫn còn tồn tại bên trong cơ thể, nên các đợt bùng phát mụn rộp sẽ vẫn còn tái diễn. Đối với những người bị nhiễm Herpes sinh dục, ngoài việc chịu đựng với các đau đớn và khó chịu từ các triệu chứng do Herpes tái phát định kỳ, họ còn phải chịu đựng các miệt thị từ xã hội, ảnh hưởng sâu sắc đến sức khỏe sinh sản và tình dục, cùng với nguy cơ mắc HIV cao, loại virus gây ra hội chứng suy giảm miễn dịch AIDS.
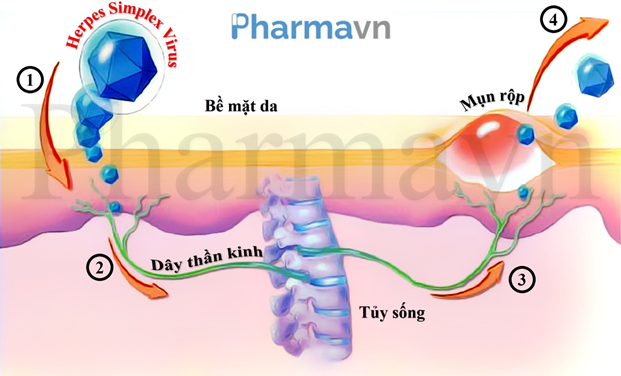
Hình 2: Con đường lây nhiễm Herpes. Virus Herpes xâm nhập vào cơ thể thông qua da (1), nhưng sẽ nhanh chóng di chuyển theo dây thần kinh để tới các tế bào thần kinh nằm ở tủy sống hoặc gần tai, nơi mà chúng sẽ trú ẩn suốt đời (2). Khi có các tác nhân kích thích hoặc theo định kỳ, virus sẽ rời khỏi nơi trú ẩn, di chuyển theo dây thần kinh để trở lại bề mặt da (3), nơi chúng gây ra các mụn rộp hay vết loét (4).
Cho đến này, các thuốc kháng virus, như Acyclovir, Famciclovir và Valacyclovir, là những loại thuốc hiệu quả nhất trong điều trị bệnh Herpes (Xem hướng dẫn điều trị Herpes do WHO khuyến cáo tại Bảng 2). Mặc dù, các loại thuốc này có thể làm giảm mức độ nghiêm trọng và tần suất hoạt động của HSV, tuy nhiên, chúng lại không thể tiêu diệt HSV hoàn toàn. Điều này là do các giới hạn trong cơ chế hoạt động của chúng. Acyclovir, Famciclovir hay Valacyclovir vốn dĩ là những chất có cấu trúc tương tự với Deoxyguanosine tham gia cấu tạo nên DNA, nhưng lại thiếu nhóm 3’-hydroxyl (-OH) (Hình 3). Khi HSV sao chép tổng hợp DNA, các chất này sẽ cạnh tranh với Deoxyguanosine để được gắn vào các mạch DNA đang tổng hợp. Vì các chất này thiếu nhóm 3’-OH cần thiết để kéo dài chuỗi DNA, nên quá trình tổng hợp DNA sẽ kết thúc sớm, dẫn đến ngăn chặn hoạt động sao chép của HSV. Điều này có nghĩa là việc điều trị chỉ có hiệu quả khi bộ gen của HSV đang nhân lên tích cực. Nếu HSV chuyển sang trạng thái ẩn và ngủ đông thì phương pháp này sẽ hoàn toàn vô hiệu.
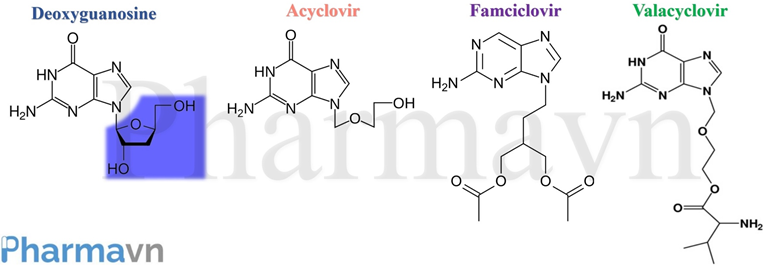
Hình 3: Cấu trúc hóa học của Deoxyguanosine, Acyclovir, Famciclovir và Valacyclovir
Phát triển vaccine cho HSV là một trong các tham vọng mà WHO và nhiều đối tác đang nỗ lực theo đuổi trong nhiều thập kỷ liền, làm tiêu tốn hàng trăm triệu đô la nhưng vẫn chưa có kết quả cuối cùng. Nguyên nhân lớn nhất nằm ở chỗ khác với các virus thông thường, HSV có cơ chế hoạt động phức tạp giúp chúng lẩn tránh khỏi quá trình trình diện kháng nguyên với phân tử phức hợp hòa hợp mô chính nhóm I (MHC I – Major Histocompatibility Complex class 1), một trong những con đường quan trọng giúp hệ thống miễn dịch chống lại sự nhiễm virus. Thông thường, khi một virus xâm nhập vào bên trong tế bào, chúng sẽ bắt đầu nhân lên và tổng hợp nên các protein của chính chúng. Các tế bào miễn dịch sẽ không thể nhìn thấy các hoạt động này bên trong tế bào và do đó sẽ không biết đâu là các tế bào bị nhiễm. Để khắc phục điều này, các tế bào sẽ sử dụng một hệ thống cho phép chúng hiển thị là chúng đang bị nhiễm để các tế bào miễn dịch tới giải cứu chúng, hệ thống này gọi là MHC I. Quá trình đó hoạt động như sau: Tại tế bào chất của tế bào bị nhiễm, protein của virus sẽ bị nghiền nát thành các mảnh vụn peptide bởi các Proteasome. Sau đó, các peptide kháng nguyên nội bào này sẽ được vận chuyển vào mạng lưới nội chất thông qua protein vận chuyển có tên là TAP (Transporter associated with Antigen Processing) để được gắn vào phân tử MHC I. Kế tiếp, phức hợp MHC I và peptide sẽ được đóng gói và vận chuyển lên bề mặt tế bào nhằm trình diện kháng nguyên cho hệ thống miễn dịch. Tại bên ngoài tế bào, tế bào T CD8+ đến và nhận ra đây là các peptide ngoại lai, nghĩa là các tế bào này đang bị virus xâm nhiễm. Do đó, chúng sẽ kích hoạt cơ chế gây độc bằng Perforin/Granzyme: perforin làm thủng màng tế bào, sau đó granzyme đi vào tế bào để kích hoạt hàng loạt các chuỗi phản ứng tại tế bào chất, ti thể và nhân tế bào gây apoptosis (chết tế bào theo chu trình) lên các tế bào này. Như vậy, các tế bào nhiễm virus đã bị hệ thống miễn dịch loại bỏ hoàn toàn. Tuy nhiên ở một số virus, chúng có khả năng thích nghi cao và đã phát triển ra cách để ngăn các phân tử MHC I đi lên bề mặt tế bào. Nếu điều này xảy ra, tế bào T CD8+ sẽ không biết được đâu là tế bào bị nhiễm và do đó các virus này sẽ trốn tránh được hệ miễn dịch. Thú vị là bản thân hệ miễn dịch của chúng ta cũng biết cách tự tiến hóa để chống lại điều này: Khi các MHC I bị ngăn chặn, chúng sẽ biểu hiện ít trên bề mặt tế bào. Dựa trên điều này, hệ miễn dịch của chúng ta đã sử dụng một tế bào miễn dịch khác có chức năng chuyên tiêu diệt các tế bào có số lượng phân tử MHC I giảm trên bề mặt tế bào – các tế bào này gọi là tế bào giết tự nhiên (Natural Killer cell-NK). Khi tế bào NK phát hiện một tế bào có ít phân tử MHC I hơn bình thường, chúng sẽ giải phóng các chất độc, theo cách tương tự như các tế bào T gây độc tế bào, giết chết tế bào bị nhiễm virus.
Tuy nhiên, quả quýt dày sẽ có móng tay nhọn, ngay cả với các cơ chế tuyệt vời như vậy, hệ miễn dịch của chúng ta vẫn bị HSV qua mặt. Ở HSV, để thoát khỏi hệ thống miễn dịch, chúng đã tổng hợp protein ICP47 có chức năng khóa hoạt động của TAP từ phía tế bào chất giúp chặn cầu nối với lưới nội chất. Bằng cách ngăn chặn các peptide kháng nguyên nội bào xâm nhập vào mạng lưới nội chất, sẽ không có peptide nào được liên kết với MHC 1. Do đó, MHC 1 vẫn di chuyển lên bề mặt tế bào bình thường nhưng không có peptide ngoại lai nào được trình diện. Từ đó, HSV đã thực sự ẩn khỏi các tế bào T CD8+, góp phần hình thành bệnh nhiễm trùng suốt đời ở vật chủ [3, 4] (Hình 4). Ngoài ra, một nguyên nhân nữa giúp HSV lẩn tránh khỏi hệ miễn dịch là do HSV trú ngụ trong các tế bào thần kinh, vốn dĩ mang ít phân tử MHC I, chính điều này làm cho việc các tế bào T CD8+ sẽ khó khăn khi nhận ra các tế bào bị nhiễm bệnh và tấn công chúng. Điều này là phù hợp bởi biểu hiện mức độ MHC I thấp ở các tế bào thần kinh sẽ giúp chúng ta giảm thiểu mức độ ảnh hưởng tới hệ thần kinh, vì các tế bào thần kinh thì không có khả năng tái tạo, sẽ thật nguy hiểm khi nó sẽ bị tấn công bởi tế bào T CD8+.

Hình 4: Cơ chế trốn tránh hệ miễn dịch của HSV. Thông thường, khi một virus xâm nhập vào bên trong tế bào, protein của chúng sẽ bị proteasome nghiền nát thành các mảnh vụn peptide (1). Sau đó, các peptide này sẽ được TAP vận chuyển vào mạng lưới nội chất để được gắn vào phân tử MHC 1 có nhiệm vụ vận chuyển peptide lên bề mặt tế bào (2). Tế bào T CD8+ đến, nhận diện peptide ngoại lai và tiêu diệt các tế bào bị nhiễm virus bằng Perforin/Granzyme (3). Ở HSV, virus sẽ tổng hợp ICP47 (4) giúp chặn con đường vận chuyển TAP, dẫn đến sự xuất hiện của các phân tử MHC 1 trống (5). Do đó, các tế bào T CD8+ sẽ không biết rằng các tế bào này đang nhiễm HSV (6). MHC 1: Major Histocompatibility Complex class 1; TAP: Transporter associated with Antigen Processing; PLC: Peptide-Loading Complex. Gene IE: Immediate-early gene.
Việc nghiên cứu thuốc đủ đặc hiệu trong điều trị bệnh do HSV là khá khó khăn vì rất có thể vô tình ảnh hưởng đến TAP và một số chất vận chuyển khác tương tự, khiến gián đoạn nhiều quá trình trong tế bào và gây ra tác dụng phụ lớn. Thêm nữa, HSV vốn dĩ trú ngụ trong các tế bào thần kinh, do đó nếu hệ thống miễn dịch của chúng ta tiêu diệt HSV, điều này đồng nghĩa với việc chúng ta đang tự tấn công lên hệ thần kinh cuả mình, gây hậu quả đặc biệt nghiêm trọng. Hiện tại, các ứng cử viên vaccine tiềm năng đang được phát triển là (Hình 5) [5]:
- HSV529 (HSV15) là vaccine chứa HSV bị khiếm khuyết chức năng sao chép DNA do không có 2 protein UL5 và UL29, được phát triển bởi Sanofi Pasteur và đã có kết quả nghiên cứu pha 1/2 vào ngày 7/8/2020.
- EXD-12 là vaccine chứa HSV bị giảm độc lực, được phát triển bởi Excell Biotech, đang được thử nghiệm tiền lâm sàng về độ an toàn và hiệu lực.
- ΔgD-2 là vaccine chứa HSV bị suy giảm khả năng lây nhiễm tế bào do đã bị xóa gen ΔgD, được phát triển bởi X-Vax Technology. Kết quả gần nhất (ngày 16/6/2020) cho thấy ΔgD-2 tạo ra kháng thể đa chức năng giúp chống lại HSV ở mắt.
- NanoVax là vaccine dùng trong mũi, đã được chứng minh tính an toàn và hiệu quả trong mô hình động vật cả về phòng ngừa và điều trị bệnh Herpes sinh dục.
- SB208141 do GSK phát triển, đang được tiến hành thử nghiệm lâm sàng pha 3: thử nghiệm ngẫu nhiên, có đối chứng và mù đôi (double-blind).
Nhìn chung, các loại vaccine này vẫn còn hạn chế do hoạt động dựa trên bộ máy miễn dịch của tế bào, có nghĩa là chỉ có thể kiểm soát virus thay vì tấn công thẳng vào nguyên nhân gốc rễ của sự lây nhiễm. Do đó, hiện nay, nhiều hãng dược đã bắt đầu từ bỏ việc phát triển vaccine và tập trung nghiên cứu thuốc tiêu diệt HSV theo những hướng khác. Một trong những hướng tiềm năng nhất hiện nay phải kể đến là sự bùng nổ của một công cụ sinh học mạnh mẽ, đã trở thành một câu chuyện lịch sử trong giới khoa học.
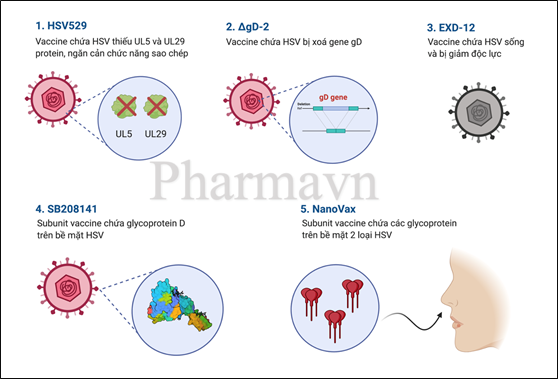
Hình 5: Cơ chế của các ứng cử viên tiềm năng cho bệnh Herpes. HSV529 là vaccine chứa HSV bị khiếm khuyết protein UL5 và UL29, do đó đột biến này ngăn cản khả năng sao chép của virus. ΔgD-2 là vaccine chứa HSV bị xoá gene mã hoá glycoprotein D (protein giúp HSV xâm nhập vào tế bào vật chủ). EXD-12 là vaccine chứa HSV sống nhưng bị giảm độc lực. SB208141 và NanoVax đều là subunit vaccine, nhưng SB208141 chứa glycoprotein D của HSV còn NanoVax chứa nhiều loại glycoprotein trên bề mặt 2 loại HSV.
Chỉnh sửa gene – Bước ngoặt mới trong điều trị Herpes
Chỉnh sửa gen (gene-editing) là một nhóm các kỹ thuật di truyền cho phép các nhà khoa học chèn, xóa hoặc sửa đổi các vị trí cụ thể trong bộ gene của một sinh vật sống (Hình 6). Mặc dù công nghệ chỉnh sửa gene đã tồn tại từ những thập kỷ 1970, tuy nhiên mãi tới khi CRISPR/Cas9 được phát hiện, cho phép chỉnh sửa gene dễ dàng, chính xác, nhanh chóng và rẻ hơn bao giờ hết, thì cuộc cách mạng chỉnh sửa gen mới thực sự bùng nổ. Nó đã dẫn đến các bước tiến mới trong lĩnh vực di truyền học: đẩy mạnh nghiên cứu chức năng bộ gen và sự tương tác giữa các gen; thúc đẩy quá trình thiết lập các mô hình động vật chuyển gen và đẩy nhanh quá trình mô hình hóa bệnh tật ở người, giúp phát hiện ra các phương pháp điều trị mới, phát triển thuốc và cấy ghép nội tạng; cho phép tạo ra các giống cây trồng với các đặc điểm mong muốn mà không cần phải đưa vào các DNA ngoại lai. Đặc biệt là trong lĩnh vực y học, cụ thể là liệu pháp gen, chỉnh sửa gen là một công nghệ rất hữu ích, giúp sửa chữa trực tiếp các đột biến gen trong các mô và tế bào mục tiêu để điều trị các bệnh mà theo các liệu pháp truyền thống là khó điều trị, như ung thư, bệnh tim, bệnh tâm thần và HIV [6]. Các cách sử dụng chỉnh sửa gen để điều trị bệnh trong liệu pháp gen bao gồm: 1/bất hoạt hoặc sửa chữa các đột biến có hại; 2/đưa các đột biến bảo vệ (protective mutations) có chức năng ngăn chặn sự biểu hiện của kiểu hình bệnh; 3/chèn các gen ngoại sinh trị liệu; 4/phá hủy DNA của virus.
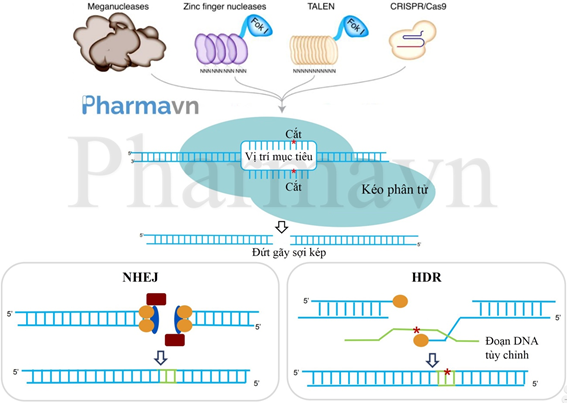
Hình 6: Cơ chế hoạt động của công cụ chỉnh sửa gen. Các chiếc kéo phân tử, như Meganucleases, Zinc finger nucleases, TALEN, CRISPR/Cas9, sẽ được các phân tử hướng dẫn đưa đến vị trí DNA mục tiêu, nơi chúng gây đứt gãy sợi kép DNA. Sau đó, các nhà nghiên cứu sẽ lợi dụng cơ chế sửa chữa DNA của chính tế bào theo con đường tái tổ hợp không tương đồng (NHEJ-Non Homologous End Joining) hoặc tái tổ hợp tương đồng (HDR-Homology Directed Repair) để xóa, chèn hoặc thêm các phần vật liệu di truyền hoặc thay đổi trình tự DNA bằng cách thay thế đoạn hiện có bằng một đoạn DNA tùy chỉnh.
Đối với bệnh Herpes, chỉnh sửa gen được cho là một công cụ đầy tiềm năng, được tin rằng có khả năng chữa khỏi hoàn toàn các bệnh nhiễm trùng tiềm ẩn do HSV gây ra. Cách thức rất đơn giản: Với chỉnh sửa gen, các nhà nghiên cứu sẽ sử dụng các vector để đưa các chiếc kéo phân tử vào các tế bào mục tiêu. Sau đó, kéo phân tử sẽ đến và cắt bỏ các phần DNA đặc trưng của virus Herpes dẫn đến vô hiệu hóa hay về cơ bản là tiêu diệt toàn bộ HSV, mà vẫn bảo tồn các tế bào thần kinh này. Nếu cơ chế này hoạt động một cách hiệu quả, về cơ bản là một người bị mụn rộp sau đó sẽ được chữa khỏi hoàn toàn [7].
Thực tế, những tiến bộ trong nghiên cứu chữa bệnh Herpes trong 5 năm gần đây phần lớn là do một loạt các cải tiến trong các công cụ chỉnh sửa gen. Các nghiên cứu này đơn giản là việc các nhà khoa học sẽ thực hiện các thử nghiệm lặp đi lặp lại nhằm xem tìm ra cách tăng hiệu quả chỉnh sửa gene nhiều nhất. Các câu hỏi cần trả lời chẳng hạn như: loại kéo phân tử nào có hiệu quả cắt gen hiệu quả nhất, vector virus nào vận chuyển các chiếc kéo phân tử này đến tế bào mục tiêu tốt nhất, hay cách tốt hơn để nhắm mục tiêu vào các cụm tế bào thần kinh bị nhiễm bệnh và ngăn chặn khả năng sửa chữa nhanh chóng các vết cắt trên gen của virus là gì?
Đột phá trong điều trị bệnh Herpes
Vừa qua, ngày 18/08/2020, tạp chí Nature Communications đã công bố kết quả nghiên cứu của nhóm khoa học tại Viện Ung thư Fred Hutchinson, Mỹ cho thấy sử dụng chỉnh sửa gen bằng Meganuclease và phương tiện vận chuyển Adeno-Associated Virus có thể tiêu diệt lên tới 90% lượng HSV-1 tiềm ẩn bên trong chuột thí nghiệm, một mức độ đủ để các nhà nghiên cứu tin rằng nó sẽ ngăn chặn khả năng hoạt động trở lại của loại virus này [8]. Công bố này đã trở thành một tiếng vang không chỉ trong giới khoa học nói riêng mà còn trong cả trong cộng đồng người nhiễm Herpes nói chung. Về phía các nhà khoa học, đây là lần đầu tiên mà họ thực sự có thể đi vào và loại bỏ hầu hết các mụn rộp trong cơ thể, điều mà đã luôn là một thách thức trong nhiều thập kỷ dài. Còn về phía bệnh nhân, đây là hy vọng, là sự lạc quan, bởi họ có thể chắc chắn rằng trong suốt cuộc đời của mình, họ có thể thoát khỏi căn bệnh quái ác này.
Kết quả này không gì hơn hết là một sự kiên trì mòn mỏi của nhóm nghiên cứu để ngăn chặn một loại virus dai dẳng. Chỉ mới 5 năm trước đây, kết quả đầu tiên của nhóm nghiên cứu chỉ nằm ở khoảng 2%-4% lượng HSV là bị làm hỏng gen ở những con chuột bị nhiễm bệnh. Nhưng mà giờ đây, thông qua một loạt các cải tiến gia tăng trên phương pháp ban đầu, con số này đã tăng lên tới 92% tại hạch thần kinh cổ trên (superior cervical ganglia), là mô thần kinh nơi phần lớn HSV-1 trú ngụ. Sự suy giảm này duy trì trong vòng 1 tháng, và được các nhà nghiên cứu tin rằng đủ để ngăn chặn sự hoạt động trở lại của HSV-1.
Các tinh chỉnh mà nhóm nghiên cứu đã làm trong nghiên cứu này bao gồm [9]:
- Kéo phân tử bằng Meganuclease cắt gene hiệu quả hơn so với CRISPR/Cas9. Ngạc nhiên là mặc dù CRISPR/Cas9 là chiếc kéo phân tử vàng trong lĩnh vực chỉnh sửa gen. Tuy nhiên, trong nghiên cứu điều trị Herpes, nó lại không hoạt động tốt bằng Meganuclease. Điều này có thể là do, CRISPR/Cas9 là một phân tử lớn, trong khi các Meganuclease tương đối nhỏ hơn, chỉ bằng một nửa kích thước của một kháng thể, do đó sẽ dễ dàng được đóng gói và phân phối đến các tế bào thần kinh hơn. Ngoài ra, khả năng nhăm mục tiêu của Meganuclease đến các bộ gen virus dị hóa cũng chính xác hơn CRISPR/Cas9, phù hợp với sự tiến hóa của Meganuclease vốn nằm ở sinh vật nhân chuẩn, so với sự tiến hóa của CRISPR/Cas9 nằm ở sinh vật nhân sơ.
- Sử dụng hỗn hợp 2 hay 3 loại Meganuclease khác nhau thay vì chỉ 1 loại. Cách đây nhiều năm, nhóm đã đạt được kết quả đầy hứa hẹn trong việc cắt DNA của virus Herpes bằng cách sử dụng 1 loại Meganuclease duy nhất, nhưng kết quả chỉ tồn tại trong một thời gian ngắn. Điều này là bởi vì HSV có thể dựa vào các chương trình sửa chữa DNA của chính các tế bào bị nhiễm để tự phục hồi (vốn không phân biệt giữa các gen của virus ngoại lai với các gen của bản thân tế bào). Nhưng theo thời gian, các nhà nghiên cứu phát hiện ra rằng họ có thể loại bỏ tới 90% vi rút tiềm ẩn bằng cách sử dụng hỗn hợp 2 hoặc 3 loại Meganuclease khác nhau để cắt các vị trí khác nhau trên bộ gene virus. Nó chỉ đơn giản là tế bào khó sửa chữa hai lần đứt hơn một. Với nhiều hơn 2 lần đứt, các tế bào sẽ nhận thấy rằng DNA của virus đã quá hư hỏng để được sửa chữa, nên sẽ kêu các phân tử khác đến để loại bỏ DNA của virus ra khỏi cơ thể tế bào.
- Sử dụng kết hợp ba loại vector AAV khác nhau để vận chuyển Meganuclease sẽ giảm lượng HSV ở hạch nhiều nhất. Ngay từ đầu, nhóm nghiên cứu đã sử dụng AAV (Adeno-Associated Virus) – một loại virus vô hại, bất hoạt, được hút vào các protein bề mặt của tế bào thần kinh – để làm vector vận chuyển các chiếc kéo phân tử đến các tế bào thần kinh mục tiêu. Các HSV ẩn náu trong các cụm tế bào thần kinh được gọi là hạch và các nhà nghiên cứu đã phát hiện ra rằng một số hạch khó tiếp cận hơn những hạch khác. Qua nhiều năm, họ phát hiện ra rằng một số chủng AAV phù hợp hơn những chủng khác để tìm ra các loại cụm thần kinh cụ thể, và điều này đã giúp họ tinh chỉnh việc lựa chọn các loại AVV khác nhau để phù hợp với các tế bào bị nhiễm ở những nơi khác nhau. Trong thí nghiệm này, nhóm đã lựa chọn 3 loại vector AAV khác nhau, kết quả là giảm tới 92% HSV ở hạch thần kinh cổ trên. Kết quả này cho thấy rằng các kiểu huyết thanh AAV được kết hợp để cung cấp liệu pháp Meganuclease cần được lựa chọn cẩn thận và có thể được cải thiện hơn nữa. Công việc trong tương lai nên tập trung vào việc xác định các kết hợp tối ưu của AAV để đảm bảo bao phủ đầy đủ tất cả các tế bào thần kinh bị nhiễm bệnh và xác định xem liệu các kết hợp đó có hiệu quả trong các hệ thống mô hình khác hay không, điều này sẽ tạo điều kiện thuận lợi khi phương pháp này được áp dụng trên người.
Theo tiến sĩ Martine Aubert, nhà khoa học cấp cao của Viện Ung thư Fred Hutchinson: “Đây là một phương pháp có thể chữa bệnh cho cả nhiễm HSV ở miệng và đường sinh dục”. Tuy nhiên, sẽ còn mất rất nhiều thời gian trước khi những thí nghiệm này có thể được thử nghiệm lâm sàng đầu tiên trên người như là một liệu pháp gen để chữa bệnh Herpes. Các nhà nghiên cứu hy vọng rằng điều này sẽ chỉ mất ít nhất 3 năm. Theo đà tiến tới, nhóm nghiên cứu giờ đây đang theo đuổi một chiến lược tương tự trong điều trị HSV-2. Họ cũng đang hợp tác với Tiến sĩ Barry Stoddard, người chuyên khám phá cấu trúc protein, để thiết kế riêng một bộ Meganuclease mà họ hy vọng sẽ hoạt động tốt hơn cả bộ họ đang sử dụng. Sớm thôi, một liệu pháp giúp chữa trị bệnh Herpes là một điều hoàn toàn có thể!
Bảng 1: Tổng quan về HSV-1 và HSV-2 [10, 11]
| HSV-1 | HSV-2 | |
| Đặc điểm chung | Nhiễm Herpes do HSV-1 hay HSV-2 gây ra đều kéo dài suốt đời, do hiện tại vẫn chưa có cách chữa trị hoàn toàn. | |
| Loại Herpes và đường lây nhiễm | Cả hai loại HSV-1 và HSV-2 đều có thể lây nhiễm Herpes sinh dục hay Herpes miệng. Tuy nhiên, thông thường, HSV-1 sẽ gây ra Herpes miệng thông qua tiếp xúc giữa miệng với bề mặt vùng bị nhiễm có các vết loét đang hoạt động hoặc ngay cả khi không có vết loét, và HSV-2 sẽ gây ra Herpes sinh dục thông qua đường tình dục – mỗi chủng virus sẽ thích sống trên các khu vực riêng ưa thích của chúng.
Trong một số trường hợp hiếm hoi, nhiễm HSV-1 và HSV-2 có thể được truyền từ mẹ sang con khi sinh (khoảng 10 trên 100.000 ca sinh trên toàn cầu), gây ra bệnh Herpes ở trẻ sơ sinh, có thể dẫn đến tàn tật thần kinh hoặc tử vong. Nguy cơ mắc bệnh Herpes ở trẻ sơ sinh cao nhất khi người mẹ bị nhiễm HSV lần đầu tiên vào cuối thai kỳ, một phần vì mức độ HSV trong đường sinh dục cao nhất trong giai đoạn đầu bị nhiễm. Lưu ý: Vì HSV nhanh chóng chết bên ngoài cơ thể, bạn không thể bị nhiễm Herpes khi ôm, nắm tay, ho, hắt hơi hoặc ngồi trên bệ toilet. |
|
| Dịch tễ | Ước tính năm 2016 có khoảng 3,7 tỷ người dưới 50 tuổi (chiếm 67% dân số) bị nhiễm HSV-1. | Ước tính năm 2016 có khoảng 491 triệu người từ 15 đến 49 tuổi (chiếm 13% dân số) bị nhiễm HSV-2. |
| Dấu hiệu và triệu chứng | Đối với Herpes miệng, hầu hết không có triệu chứng nên bệnh nhân hầu như không biết mình đã bị nhiễm. Các triệu chứng bao gồm: cảm thấy ngứa ngáy hoặc nóng rát quanh miệng trước khi xuất hiện các mụn nước, vết loét gây đau đớn ở trong hoặc xung quanh miệng, môi hoặc cổ họng. Sau đợt bùng phát đầu tiên, các mụn nước hoặc vết loét có thể tái phát định kỳ với tần suất khác nhau ở mỗi người.
Đối với Herpes sinh dục, có thể không có triệu chứng hoặc có nhưng nhẹ, khó nhận biết được. Các triệu chứng bao gồm: 1 hoặc nhiều mụn nước, vết loét ở bộ phận sinh dục hoặc hậu môn. Sau đợt bùng phát đầu tiên, các triệu chứng có thể tái phát nhưng thường không thường xuyên như Herpes sinh dục do HSV-2 gây ra. |
Đối với Herpes sinh dục, khoảng 10-20% những người bị nhiễm HSV-2 là được chẩn đoán, trong đó chỉ có khoảng 1/3 là xuất hiện triệu chứng, do đó phần lớn bệnh nhân không biết mình đã bị nhiễm. Các triệu chứng bao gồm: sốt, đau nhức cơ thể, đau nhói ở chân, hông, mông, sưng hạch bạch huyết, xuất hiện một hoặc nhiều mụn nước, vết loét ở bộ phận sinh dục hoặc hậu môn. Sau đợt bùng phát đầu tiên, các triệu chứng tái phát thường xuyên nhưng thường ít nghiêm trọng hơn. Tần suất bùng phát có xu hướng giảm dần theo thời gian nhưng có thể diễn ra trong nhiều năm. |
| Mối liên quan với HIV | Ở những người bị suy giảm miễn dịch, như người bị nhiễm HIV giai đoạn nặng, HSV-1 có thể có các triệu chứng nghiêm trọng hơn và tái phát thường xuyên hơn. | HSV-2 và HIV có mối liên quan mật thiết với nhau: những người bị nhiễm HSV-2 có nguy cơ bị nhiễm HIV cao hơn gần gấp ba lần đối với dân số nói chung và gấp đôi đối với những người thuộc nhóm nguy cơ cao, như phụ nữ, nam giới hành nghề mại dâm, và nam giới quan hệ tình dục đồng giới; ngược lại, 60-90% người nhiễm HIV sẽ đồng thời bị nhiễm HSV-2.
Ở những người bị suy giảm miễn dịch, như HIV, HSV-2 có thể có biểu hiện nặng hơn và tái phát thường xuyên hơn, dẫn đến các biến chứng nghiêm trọng nhưng hiếm gặp như viêm màng não, viêm thực quản, viêm gan, viêm màng phổi, hoại tử võng mạc hoặc nhiễm trùng lan tỏa. |
| Điều trị | Các thuốc kháng virus, chẳng hạn như Acyclovir, Famciclovir và Valacyclovir, là những loại thuốc hiệu quả nhất hiện nay cho những người bị nhiễm HSV. Mặc dù không thể chữa khỏi bệnh hoàn toàn, chúng có thể giúp xoa dịu các triệu chứng của bệnh và làm giảm tần suất tái hoạt động của virus. | |
| Phòng tránh | ü Tránh tiếp xúc bằng miệng và dùng chung đồ vật có tiếp xúc với nước bọt.
ü Kiêng hoạt động tình dục khi có các triệu chứng của bệnh Herpes sinh dục. ü Những người có các triệu chứng gợi ý nhiễm Herpes sinh dục cũng nên được xét nghiệm HIV. ü Sử dụng bao cao su phù hợp và đúng cách. |
|
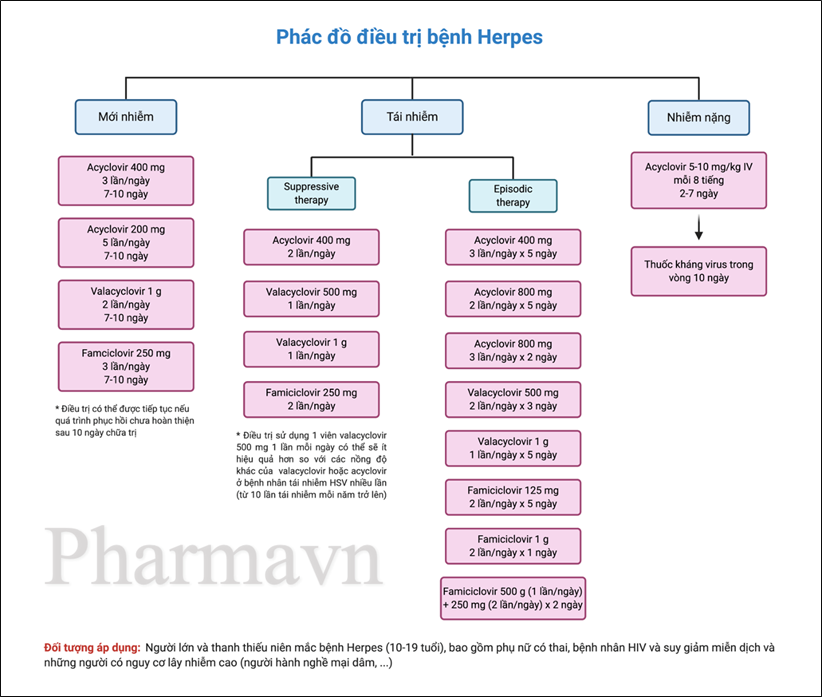
Bảng 2: Hướng dẫn điều trị Herpes của WHO (2016) [12]
| Giai đoạn lâm sàng | Khuyến cáo | Điều trị | Nội dung | |
| Mức độ khuyến cáo | Bằng chứng chất lượng | |||
| Đợt bùng phát đầu tiên | 1 | Strong (Mạnh) | Moderate (Trung bình) | Nên điều trị
Cũng áp dụng cho những người nhiễm HIV, những người bị suy giảm miễn dịch, những người ở giai đoạn nặng và phụ nữ có thai. |
| 2 | Conditional (Tùy chọn) | Moderate (Trung bình) | Đề xuất sử dụng liều Aciclovir tiêu chuẩn hơn là sử dụng Valaciclovir hoặc Famciclovir.
Liều dùng: • Aciclovir 400 mg x 3 lần/ngày x 10 ngày (liều tiêu chuẩn). • Aciclovir 200 mg x 5 lần/ngày x 10 ngày. • Valaciclovir 500 mg x 2 lần/ngày x 10 ngày. • Famciclovir 250 mg, x 3 lần/ngày x 10 ngày. (*) (**) |
|
| Tái phát (điều trị theo giai đoạn)
|
3 | Conditional
(Tùy chọn) |
Moderate (Mạnh) | Điều trị hơn là không điều trị.
Lưu ý: Nên điều trị sớm trong vòng 24 giờ kể từ khi bắt đầu xuất hiện các triệu chứng hoặc trong giai đoạn tiền triệu (prodromal phase). Khuyến cáo này cũng áp dụng cho những người nhiễm HIV, những người bị suy giảm miễn dịch và phụ nữ mang thai. |
| 4 | Conditional
(Tùy chọn) |
Moderate (Trung bình) | Đề nghị sử dụng aciclovir thay vì valaciclovir hoặc famciclovir.
Liều dùng cho người lớn, thanh thiếu niên và phụ nữ có thai: (đường uống) • Aciclovir: 400 mg x3 lần/ngày x 5 ngày, hoặc 800 mg x 2 lần/ngày x 5 ngày, hoặc 800 mg x 3 lần/ngày x 2 ngày. • Valaciclovir 500 mg x 2 lần/ ngày x 3 ngày. • Famciclovir 250 mg x 2 lần / ngày trong 5 ngày. Liều dùng cho người nhiễm HIV và người bị suy giảm miễn dịch: (đường uống) • Aciclovir 400 mg x 3 lần/ ngày x 5 ngày. • Valaciclovir 500 mg x 2 lần/ngày x 5 ngày. • Famciclovir 500 mg, x 2 lần/ngày x 5 ngày. (*) (***) |
|
| Đối tượng áp dụng: Đối với người lớn và thanh thiếu niên mắc Herpes sinh dục (10-19 tuổi), bao gồm cả phụ nữ có thai, bệnh nhân HIV và suy giảm miễn dịch và những người có nguy cơ cao (người hành nghề mại dâm,…)
(*) Mặc dù lợi ích của các loại thuốc có thể tương tự nhau, nhưng giá của Valaciclovir và Famciclovir cao hơn Aciclovir, và do đó Aciclovir được ưu tiên hơn. Việc lựa chọn liều lượng có thể phụ thuộc vào cân nhắc tuân thủ. (**) Khuyến cáo này cũng áp dụng cho những người nhiễm HIV, những người bị suy giảm miễn dịch, những người ở giai đoạn nặng và phụ nữ mang thai. (***) Điều trị nên được thực hiện trong vòng 24 giờ đầu tiên kể từ khi bắt đầu xuất hiện các triệu chứng hoặc trong giai đoạn tiền triệu. |
||||
Hình 7: Sơ đồ tóm tắt phác đồ điều trị bệnh Herpes.
Tài liệu tham khảo
- [1] Planned Parenthood, “Oral & Genital Herpes”, https://www.plannedparenthood.org/learn/stds-hiv-safer-sex/herpes, 27/09/2020.
- [2] Anthony L. Cunningham, etc., 2006, “The Cycle of Human Herpes Simplex Virus Infection: Virus Transport and Immune Control”, The Journal of Infectious Diseases, https://academic.oup.com/jid/article/194/Supplement_1/S11/893145, 27/09/2020.
- [3] Kerry Laing, “Immune responses to viruses”, British society for Immunology, https://www.immunology.org/public-information/bitesized-immunology/pathogens-and-disease/immune-responses-viruses, 27/09/2020.
- [4] Michael L. Oldham, etc., 2016, “A mechanism of viral immune evasion revealed by cryo-EM analysis of the TAP transporter”, Nature, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4848044/, 27/09/2020.
- [5] Precision Vaccinations, 2020, “Herpes Vaccine Candidates”, https://www.precisionvaccinations.com/vaccines/herpes-vaccine-candidates, 27/09/2020.
- [6] Synbio Technologies, “The Applications of Genome Editing Technology”, https://www.synbio-tech.com/genome-editing-applications/, 27/09/2020.
- [7] Mark Hay, 2019, “Why Gene Editing May Hold the Promise of a Herpes Cure”, Men’s Health, https://www.menshealth.com/health/a26306319/herpes-cure-gene-editing/, 27/09/2020.
- [8] Keith R. Jerome, etc., 2020, “Gene editing and elimination of latent herpes simplex virus in vivo”, Nature, https://www.nature.com/articles/s41467-020-17936-5, 27/09/2020.
- [9] Fred Hutch, 2020,“ A cure for herpes? There is progress to report”,https://www.fredhutch.org/en/news/center-news/2020/08/herpes-simplex-gene-therapy.html, 27/09/2020.
- [10] WHO, 2020, “Herpes simplex virus”,https://www.who.int/news-room/fact-sheets/detail/herpes-simplex-virus, 27/09/2020.
- [11] WHO, 2020, “Billions worldwide living with herpes”, https://www.who.int/news-room/detail/01-05-2020-billions-worldwide-living-with-Herpes, 27/09/2020.
- [12] WHO, 2016, “WHO guidelines for the treatment of Genital Herpes Simplex Virus”, https://www.who.int/reproductivehealth/publications/rtis/genital-HSV-treatment-guidelines/en/, 27/09/2020.