Liệu pháp tiềm năng mới điều trị giảm đau, trầm cảm và ung thư thông qua tác động lên thụ thể Opioid
Tác giả: Trần Thị Quỳnh Hoa
Mentor: Võ Đức Duy, Ph.D.
Các nhà nghiên cứu tại Khoa Nhiễm trùng và miễn dịch của Viện Sức khỏe Luxembourg (LIH) giới thiệu một phân tử mới có thể gắn và bất hoạt một thụ thể opioid ở não chưa được định danh trước đây.
Nhóm nghiên cứu sử dụng phân tử LIH383- 1 peptit cạnh tranh chọn lọc ACKR3 (ACKR3-selective subnanomolar competitor peptide) để khóa một thụ thể opioid không điển hình – ACKR3, tăng khả năng gắn của các peptit opioid được tạo ra trong hệ thống thần kinh trung ương (central nervous system, CNS) với các thụ thể opioid cổ điển, dẫn đến tăng tiết những phân tử chống trầm cảm và giảm đau tự nhiên của chúng. Nghiên cứu chỉ ra sự phát triển của một thế hệ thuốc điều trị giảm đau, chống trầm cảm và ung thư não.
Tiến sĩ Martyna Szpakowska, tác giả chính của bài báo “ ACKR3/CXCR7- một thụ thể chemokine không điển hình có khả năng diệt phổ rộng các peptit opioid” trên Nature Communications cho rằng họ phát hiện ra một cơ chế mới, chưa biết trước đây để tinh chỉnh hệ thống opioid và điều chỉnh sự phong phú của opioid tự nhiên bằng cách điều khiển thành viên thứ 5 trong họ thụ thể opioid, ACKR3”.
Các thụ thể opioid là thụ thể cặp đôi ghép với protein G (GPCRs G protein-coupled receptors đóng vai trò trung tâm trong tiến trình phần thưởng (reward processing), hưng phấn, giảm đau, căng thẳng, lo lắng và trầm cảm. Có 3 thụ thể cổ điển mu (MOR), delta (DOR) và kappa (KOR) và 1 thụ thể hấp thụ không cổ điển thứ 4-NOP.
Các peptit opioid là những protein nhỏ hoạt động như một chất điều hòa thần kinh bằng cách tương tác với các thụ thể opioid này trên bề mặt tế bào thần kinh trung ương (CNS), đóng vai trò chính trong việc làm trung gian giảm đau và cũng điều hòa cảm xúc. (Hình 1.)
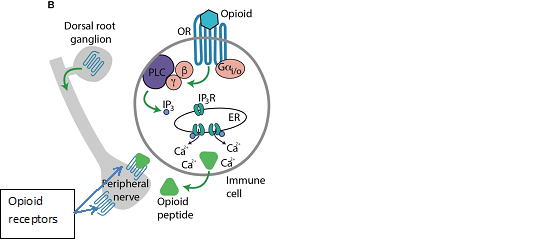
Hình 1a. Các peptit opioid (opioid peptide), thụ thể opioid (opioid receptors – OR và cơ chế giảm đau của opioid. Sau khi opioid gắn với thụ thể opioid (OR) trên tế bào miễn dịch ( Immune cell). Những hiệu ứng tế bào qua trung gian OR trong các tế bào miễn dịch. Sự hoạt hóa của bạch cầu Gi/o ghép cặp với OR dẫn đến sự hoạt hóa PLC qua trung gian Gβγ và sản xuất IP3, kích hoạt IP3R trong lưới nội chất (ER) để giải phóng Ca2 + nội bào, dẫn đến việc tiết ra các peptide opioid từ các tế bào miễn dịch. Các peptide opioid được giải phóng sẽ kích hoạt OR tế bào thần kinh và giảm đau.
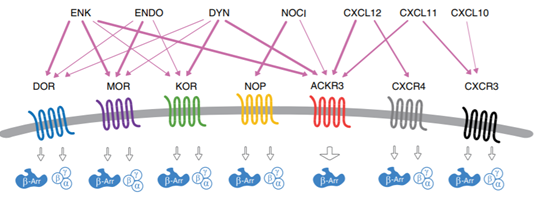
Hình 1b. Sơ đồ biểu diễn tương tác của bốn thụ thể opioid và thụ thể chemokine với các phối tử của chúng. ACKR3 được kích hoạt có chọn lọc bởi các peptit opioid nội sinh khác nhau từ các họ khác nhau (ENK- encephalin DYN- dynorphin,, NOCI – nociceptin, CXCL12 và CXCL11- 2 chemokine nội sinh) trong khoảng nồng độ tương tự như nồng độ được quan sát để kích hoạt và truyền tín hiệu qua các thụ thể opioid đã được thiết lập từ lâu, điều này chỉ ra rõ ràng về sự liên quan sinh lý của những tương tác phối tử với thụ thể mới được phát hiện này.
Đau dữ dội chủ yếu được điều trị bằng cách sử dụng các loại thuốc tác động lên hệ thống opioid này. Thuốc opioid kê đơn (bao gồm morphin, oxycodone và fentanyl) hoạt động bằng cách nhắm mục tiêu và kích hoạt các thụ thể opioid, ngăn chặn “thông điệp đau” tự nhiên khỏi bị lan truyền, thay đổi nhận thức cơn đau dẫn đến tác dụng giảm đau. Tuy nhiên, trong khi các loại thuốc này có hiệu quả, việc sử dụng chúng thường xuyên dẫn đến một số tác dụng phụ, chẳng hạn như rối loạn dung nạp, lệ thuộc và rối loạn hô hấp.
Những hạn chế của thuốc giảm đau truyền thống- opioid kê đơn:
- Cần phải tìm ra các chiến lược mới để điều chỉnh hệ thống opioid bằng cách sử dụng các loại thuốc có cơ chế hoạt động mới và giảm các biến chứng, đặc biệt là trong cuộc khủng hoảng sức khỏe cộng đồng hiện nay, có liên quan đến việc lạm dụng và nghiện opioid tổng hợp ngày càng tăng opioids.
- Hiểu rõ hơn về sự điều tiết và sai lệch tín hiệu của thụ thể opioid cũng như các chiến lược mới để điều chỉnh các thụ thể opioid với các tác dụng phụ ít hơn không chỉ kịp thời mà còn rất cần thiết.
Nhóm nghiên cứu của viện LIH phát triển LIH383 dựa trên nghiên cứu trước đó đã định danh thụ thể chemokine không điển hình, ACKR3, như một thụ thể opioid mới có đặc tính điều hòa âm tính. (negative regulatory properties). Trong nghiên cứu đó, ACKR3 được chứng minh có ái lực cao với nhiều loại peptit opioid. Nhưng sự tương tác giữa ACKR3 và các opioid này không tạo ra các tín hiệu giảm đau hoặc an thần điển hình phát sinh khi opioid liên kết với các thụ thể opioid cổ điển. Thay vào đó, ACKR3 có khả năng bẫy các opioid tự nhiên và do đó làm giảm các hoạt động giảm đau và giải lo âu của chúng. Chức năng của ACKR3 là một thụ thể nhặt rác (scavenger receptor) cho nhiều loại peptit opioid, đặc biệt là enkephalin và dynorphin, làm giảm tính khả dụng của chúng đối với các thụ thể opioid cổ điển.
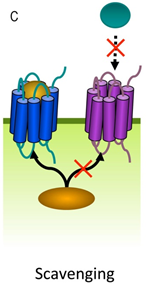
Hình 2. Cơ chế hoạt động của thụ thể “Nhặt rác” (Scavenger receptor mechanism of action). Các thụ thể nhặt rác là một “siêu họ” của các thụ thể gắn màng có khả năng gắn và nội bộ hóa các lipoprotein mật độ thấp ( low-density lipoprotein- LDL) đã được chỉnh sửa, tuy nhiên ngày nay nó được biết đến là có khả năng gắn với rất nhiều loại phối tử bao gồm các protein nội sinh (các lipoprotein, các tế bào apoptotic, cholesterol ester, các phospholipid, các proteoglycan, ferritin, and các carbohydrat) và các tác nhân gây bệnh, sau đó làm giảm tính gắn của chúng với các thụ thể khác, từ đó giảm hoạt tính ban đầu của các protein nội sinh và các tác nhân gây bệnh này . Khả năng nhận diện đa dạng này cho phép các thụ thể nhặt rác đóng vai trò quan trọng trong cân bằng nội môi và đấu tranh với bệnh tật. các thành viên nhóm thụ thể nhặt rác điều hòa nhiều trạng thái sinh lý bệnh bao gồm xơ vữa động mạch, nhiềm trùng, kiểm soát miễn dịch và ung thư.
Nhóm nghiên cứu cho rằng, điều thú vị ở chỗ ACKR3 không kích hoạt chuỗi các sự kiện tín hiệu phân tử đặc biệt nhằm dẫn đến các hiệu ứng giảm đau. Thay vào đó, ACKR3 hoạt động như một người nhặt rác (‘scavenger’), nó tịch thu các opioid có thể liên kết với các thụ thể cổ điển. Nói cách khác, ACKR3 là một thụ thể opioid không điển hình, có khả năng bẫy các peptit opioid được tiết ra và làm giảm mức độ có thể tương tác với các thụ thể truyền thống, do đó giảm thiểu hành động của chúng và hoạt động như một chất điều hòa âm tính của hệ thống opioid. (Hình 2.)
Nhóm nghiên cứu cũng phát hiện ra rằng không có loại thuốc nào trong số morphine, fentanyl hoặc naloxone, nhắm vào các thụ thể opioid cổ điển có tác dụng kích hoạt hoặc ức chế ACKR3.
- Họ đặt mục tiêu phát triển một phân tử có khả năng liên kết chặt chẽ và ngăn chặn ACKR3, với mục đích làm tăng hiệu quả tự nhiên của opioid đối với cơn đau và cảm xúc tiêu cực,. Đây là cách LIH383 được hình thành.
LIH383 được chứng minh là một chất chủ vận subnanomolar chọn lọc cao của ACKR3, nhắm mục tiêu và ngăn chặn ACKR3 một cách hiệu quả, và do đó có tác dụng chung là làm tăng tính khả dụng của các peptide opioid liên kết với các thụ thể opioid cổ điển trong não. Thật thú vị, việc chặn ACKR3 bằng LIH383 đã tác động tích cực đến tính khả dụng và tín hiệu của các peptide opioid thông qua các thụ thể cổ điển trong mô hình chuột ex vivo, cung cấp một phương pháp thay thế ban đầu và gián tiếp để điều chỉnh hệ thống.
- Các kết quả được báo cáo cung cấp những hiểu biết mới về chức năng hệ thống opioid có thể dẫn đến sự phát triển của các chiến lược điều trị thay thế.Ví dụ như để điều trị đau mãn tính, căng thẳng, lo lắng và trầm cảm, và cả điều trị ung thư.
Ngoài vai trò mới được mô tả là một thụ thể opioid, ACKR3, ban đầu được biết đến với cái tên CXCR7, trước đây được xác định là một thụ thể chemokine không điển hình cũng liên kết với các chemokine – protein nhỏ do các tế bào miễn dịch tiết ra, qua trung gian các phản ứng miễn dịch. cho thấy có liên quan đến sự khởi đầu khối u và di căn. Đặc biệt, ACKR3 có mặt rất nhiều trong các khối u như u nguyên bào thần kinh đệm và ung thư vú, và sự hiện diện của nó tương quan với tăng trưởng khối u, di căn, kháng hóa trị và tiên lượng xấu.
Như vậy, bằng những khám phá từ nghiên cứu khoa học cơ bản về vai trò kép của protein chemokine ACKR3/CXCR7, các nhà khoa học thuộc Khoa Nhiễm trùng và miễn dịch của Viện Sức khỏe Luxembourg (LIH) đã phát triển một peptit LIH383 có thể tương tác và can thiệp vào hoạt động của ACKR3 như là một bộ điều biến ACKR3, có tiềm năng là một nhóm thuốc thế hệ mới giảm đau chống trầm cảm , cũng hứa hẹn cho việc điều trị ung thư di căn. . Hy vọng LIH383 sẽ đóng vai trò là tiền thân cho sự phát triển của một nhóm thuốc mới giảm đau và chống trầm cảm, do đó đưa ra một chiến lược trị liệu sáng tạo và nguyên bản để giải quyết khủng hoảng opioid, đi đến ứng dụng cụ thể với những lợi ích hữu hình cho bệnh nhân và những cải thiện về hiệu quả lâm sàng. Nhóm nghiên cứu đã nộp đơn xin cấp bằng sáng chế hồi tháng 4 năm 2020.
1. https://www.nature.com/articles/s41467-020-16664-0.pdf
2. https://www.genengnews.com/news/blocking-newly-identified-opioid-receptor-points-to-new-therapeutics-for-pain-depression-and-cancer/?fbclid=IwAR25JGq8xGb7BwfL9_RE-X-P2vF-uNRpajM3nsggzz60DlzPB-EadnYJCg0