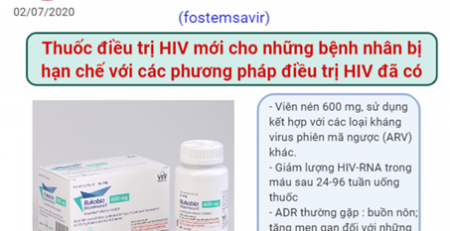
Vi khuẩn tái chế chất thải từ khối u để cung cấp ”nhiên liệu” cho tế bào miễn dịch
Tác giả: Laurence C. Chen & Yvonne Y. Chen
Các chất dinh dưỡng quan trọng cần thiết cho các tế bào miễn dịch rất khan hiếm trong các khối u. Vi khuẩn với khả năng xâm nhập vào khối u được thiết kế để tái chế chất thải của khối u thành nhiên liệu trao đổi chất để tăng cường đáp ứng miễn dịch chống ung thư ở các mô hình nghiên cứu trên chuột.
Khai thác hệ thống miễn dịch của bệnh nhân để nhắm mục tiêu vào khối u – một liệu pháp miễn dịch ung thư – trở thành một lựa chọn điều trị ung thư đầy hứa hẹn. Tế bào C (TC = T Cell) là một loại tế bào miễn dịch có chức năng giám sát và tiêu diệt các tế bào ngoại lai hoặc bị nhiễm bệnh được coi là mối đe dọa. Những đặc tính này đã gắn kết các TC trở thành một trụ cột trung tâm của các liệu pháp miễn dịch ung thư. Việc tạo ra TC phản ứng chống u hiệu quả phụ thuộc chủ yếu vào sự sẵn có của các chất dinh dưỡng như axit amin L-arginine. Tuy nhiên, môi trường vi mô khối u đặt ra một thách thức vì nó rất nghèo dinh dưỡng. Canale và cộng sự cho thấy rằng việc điều trị trên chuột bằng vi khuẩn được thiết kế chuyển hóa tạo ra nguồn L-arginine cục bộ, liên tục trong môi trường vi mô khối u, dẫn đến TC phản ứng kháng lại khối u được kéo dài, mạnh mẽ khi kết hợp với một hình thức điều trị miễn dịch khác được gọi là phong tỏa điểm kiểm soát.
Trước đây, người ta đã chỉ ra rằng việc bổ sung L-arginine kéo dài thời gian tồn tại của TC, tăng cường tạo ra phản ứng kéo dài trí nhớ tế bào và cải thiện hiệu quả tiêu diệt khối u ở mô hình chuột bị ung thư da được gọi là ung thư hắc sắc tố (melanoma). Tuy nhiên, điều trị lâm sàng bằng bổ sung L-arginine không đơn giản. Sử dụng đường uống sẽ yêu cầu bệnh nhân tiêu thụ một lượng lớn axit amin không thực tế mỗi ngày, trong khi tiêm trực tiếp vào khối u chỉ có thể thực hiện được đối với các khối u gần bề mặt da và có thể không hiệu quả do rò rỉ axit amin ra khỏi khối u. Các tác giả đưa ra giả thuyết rằng một chiến lược cung cấp L-arginine cục bộ, liên tục trong môi trường vi mô khối u sẽ hỗ trợ cho liệu pháp miễn dịch TC (Hình 1).
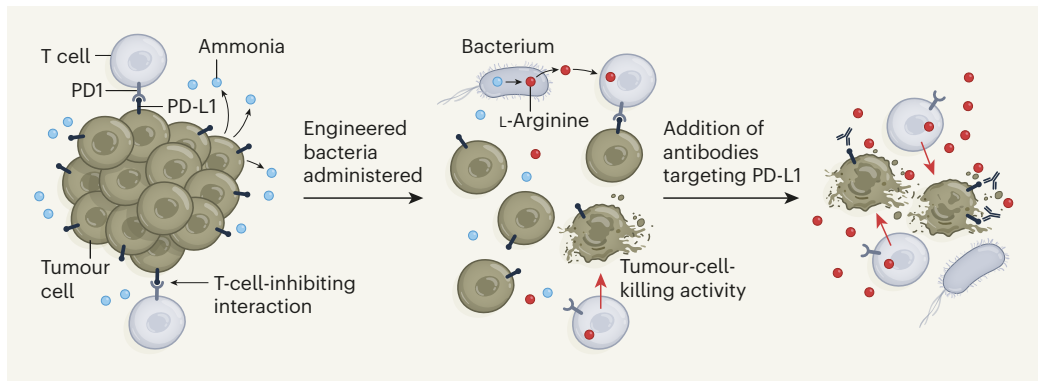
Hình 1 | Một cách tiếp cận tăng cường phản ứng miễn dịch kháng u. Các tế bào miễn dịch TC phải đối mặt với nhiều thách thức khác nhau cản trở khả năng tiêu diệt tế bào khối u của chúng. Môi trường vi mô khối u nghèo chất dinh dưỡng cần thiết cho các tế bào miễn dịch và có nhiều chất thải chuyển hóa từ tế bào khối u, chẳng hạn như amoniac. Hơn nữa, hoạt động của TC có thể bị ức chế do tương tác giữa protein PD-1 trên tế bào miễn dịch và protein PD-L1 trên tế bào khối u. Canale và cộng sự chứng minh rằng vi khuẩn được thiết kế chuyển hóa có thể chuyển đổi amoniac thành axit amin L-arginine vượt qua sự thiếu hụt L-arginine trong vi môi trường khối u ở chuột, và do đó tăng cường chức năng của TC và sự xâm nhập vào khối u.
Amoniac là chất thải của quá trình trao đổi chất của tế bào ung thư tích tụ trong môi trường vi mô của khối u, và nó có thể được chuyển đổi bằng enzym thành L-arginine. Các tác giả đã xác định hai bước quan trọng trong quá trình sinh tổng hợp L-arginine. Chúng yêu cầu protein argR nhằm ngăn chặn sinh tổng hợp L-arginine và enzyme argA. Nồng độ cao của L-arginine nội bào ức chế việc sản xuất axit amin của argA thông qua phản hồi tiêu cực.
Canale và các đồng nghiệp đã tìm cách tận dụng kiến thức này khi sản xuất vi khuẩn biến đổi gen. Vi khuẩn có thể cư trú tại môi trường vi mô khối u, cư trú ở những vị trí này và phát triển mạnh mẽ. Chủng vi khuẩn Escherichia coli Nissle 1917 (ECN) là vô hại và có lịch sử lâu đời ở lĩnh vực y tế như điều trị, vắc xin và chẩn đoán bệnh.
Các tác giả đã nghiên cứu và thực hiện các thao tác di truyền trên những vi khuẩn này, xóa gen mã hóa argR và đưa vào một phiên bản đột biến của argA không bị ức chế bởi phản hồi tiêu cực. Do đó, một chủng ECN đã được tạo ra mà các tác giả gọi là vi khuẩn L-Arg, chúng chuyển đổi amoniac thành L-arginine cả trong ống nghiệm và trong môi trường vi mô khối u.
Các tác giả báo cáo rằng việc tiêm vi khuẩn L-Arg vào chuột mang khối u dẫn đến sự gia tăng các TC tấn công khối u (TC thông thường) và giảm các TC ức chế miễn dịch (TC điều hòa). Gia tăng sự xâm nhập của khối u bởi các TC thông thường đã bổ sung hiệu quả điều trị của liệu pháp miễn dịch phong tỏa điểm kiểm soát.
Cách tiếp cận thứ hai sử dụng các kháng thể nhắm mục tiêu protein PD-L1, được tìm thấy trên các tế bào khối u và trên các tế bào ức chế miễn dịch khác, do đó ngăn chặn việc PD-L1 ức chế hoạt động của các TC nhắm mục tiêu khối u.
Trong mô hình chuột bị ung thư ruột kết, điều trị bằng vi khuẩn L-Arg cùng với kháng thể nhắm mục tiêu PD-L1 có tác dụng kháng u vượt trội so với hiệu quả được thấy ở động vật chỉ nhận một trong hai liệu pháp. Hơn nữa, liệu pháp kết hợp này còn hình thành các TC nhớ và hiệu quả điều trị phụ thuộc vào TC. Khi các TC lấy từ động vật đã được điều trị và chuyển sang động vật mang khối u chưa được điều trị trước đó, sự phát triển của khối u cũng bị ngăn chặn.
Điều quan trọng là tác động của vi khuẩn L-Arg đã được quan sát thấy khi vi khuẩn được tiêm trực tiếp vào khối u hoặc vào máu. Kết quả tương tự khi thực hiện cùng một loại thử nghiệm trên một mô hình chuột khác bị ung thư tế bào hắc tố (B16-OVA), trong đó động vật được điều trị bằng các TC nhắm mục tiêu cụ thể đến protein ovalbumin liên kết với loại khối u này.
Công trình tiên phong của Canale và các đồng nghiệp cung cấp hỗ trợ đáng kể cho việc sử dụng chế phẩm từ vi khuẩn nhằm điều hòa các yếu tố trong môi trường vi khối u. Cần thêm các nghiên cứu chuyên sâu để trả lời một số câu hỏi chính có thể giúp mở đường cho việc triển khai lâm sàng. Đầu tiên, mặc dù hành vi di chuyển cùng khối u của các vi khuẩn như ECN đã được ghi chép rõ ràng, nhưng cơ chế chính xác của quá trình này vẫn chưa rõ ràng. Kết quả là các câu hỏi vẫn còn tồn tại về cả hiệu quả và sự an toàn của nó đối với con người. Mặc dù những con chuột được điều trị bằng vi khuẩn L-Arg không có dấu hiệu nhiễm độc rõ ràng, nhưng trọng lượng cơ thể đã giảm thoáng qua. Liệu tác động của việc điều trị sẽ giảm bớt hoặc được khuếch đại hơn ở người vẫn cần được khám phá.
Thứ hai, hiệu quả của các chiến lược định hướng chuyển hóa, chẳng hạn như chuyển đổi amoniac thành L-arginine, có thể phụ thuộc vào loại khối u cụ thể. Việc nghiên cứu sâu hơn về các đặc tính nội tại của khối u và môi trường vi mô của chúng có thể rất quan trọng trong hiệu quả lựa chọn và điều trị cho bệnh nhân bao gồm vệc khiến các loại ung thư cụ thể nhạy cảm hơn hoặc kháng thuốc hơn trong chiến lược điều trị.
Cuối cùng, như với tất cả các phương pháp điều trị dựa trên tế bào biến đổi gen, cần phải xem xét đến tính ổn định di truyền của sinh vật đã được biến đổi. Phân tích chuyên sâu là cần thiết để xác định xem liệu các tính năng khác, chẳng hạn như việc sử dụng các gen ‘tự sát’ để cho phép tiêu diệt có kiểm soát các vi khuẩn được biến đổi gen, có cần thiết để đảm bảo an toàn ngắn hạn và dài hạn cho bệnh nhân hay không.
Canale và cộng sự đã nêu bật một cách tiếp cận mới bằng cách sử dụng các vi sinh được thiết kế để giải quyết các thách thức trao đổi chất do môi trường vi mô khối u gây ra. Bằng cách chuyển đổi chất thải có nguồn gốc từ khối u thành nhiên liệu trao đổi chất cho các TC phản ứng với khối u, vi khuẩn L-Arg tạo ra các phản ứng kháng u mạnh hơn và bền hơn. Mặc dù tính an toàn của phương pháp điều trị cần được khám phá rộng rãi hơn trước khi có thể chuyển sang sử dụng lâm sàng, nhưng công trình nghiên cứu của Canale và các đồng nghiệp cung cấp một bước tiến rất cần thiết cho liệu pháp miễn dịch ung thư.
Credit: Trương Hoàng Thiện, nhóm Pharmvn.org
Hiệu đính: Ds. Trần Thị Quốc Tuyến, PharmD
Nguồn: https://www.nature.com/articles/d41586-021-02639-8
Image from stock.adobe.com