Kết hợp chỉnh sửa gen Crispr-Cas9 và hệ thống vận chuyển bằng các hạt nano lipid hứa hẹn giúp điều trị ung thư không tác dụng phụ
Tác giả: Nguyễn Thái Minh Trận
Hiệu đính: TS. Võ Đức Duy
Kể từ khi được khám phá vào năm 2012, chỉnh sửa gen CRISPR-Cas9 đã gây bão trong thế giới y học. Với khả năng chỉnh sửa các đột biến gây bệnh, CRISPR-Cas9 hứa hẹn sẽ là một liệu pháp mạnh mẽ giúp chữa trị ung thư. Tuy nhiên, cho đến nay, điều này đã không khả thi do vẫn còn thiếu một hệ thống vận chuyển mang CRISPR-Cas9 đến các tế bào ung thư mục tiêu một cách an toàn, hiệu quả và chính xác. Vừa qua, các nhà nghiên cứu tại Đại học Tel Aviv (TAU), Israel đã giúp giải quyết vấn đề này. Bằng cách sử dụng một hệ thống vận chuyển mới từ các hạt nano lipid, các nhà nghiên cứu đã lần đầu tiên cho thấy CRISPR-Cas9 giúp cải thiện đáng kể tỷ lệ sống sót của các con chuột bị u nguyên bào thần kinh đệm và ung thư buồng trứng di căn mà không để lại bất kỳ tác dụng phụ nào. Đây được xem là một dấu mốc quan trọng hứa hẹn mở đầu cuộc cách mạng không chỉ trong điều trị ung thư mà ngay cả các bệnh di truyền hiếm gặp hay các bệnh mãn tính do virus gây ra như AIDS.
Giới hạn của công nghệ chỉnh sửa gen CRISPR-Cas9 trong triển khai lâm sàng
Trong những năm gần đây, các chất ức chế phân tử trúng đích và liệu pháp miễn dịch được xem là những cách hiệu quả nhất trong điều trị ung thư. Tuy nhiên, tỷ lệ tái phát cao và sự gia tăng của tình trạng kháng thuốc đối với hầu hết các loại ung thư đã cho thấy sự cần thiết của các phương thức điều trị mới. Bên cạnh đó, hầu hết các loại thuốc điều trị ung thư hiện nay đều yêu cầu phải sử dụng lặp lại nhiều lần, điều này làm tăng độc tính, chi phí điều trị và làm giảm nghiêm trọng chất lượng cuộc sống của bệnh nhân. Chỉnh sửa gen CRISPR-Cas9 có khả năng phá hủy hoàn toàn các DNA chịu trách nhiệm cho khả năng sống sót của tế bào ung thư, là một phương thức điều trị mới mẻ giúp khắc phục việc sử dụng lặp lại nhiều lần của các loại thuốc điều trị ung thư truyền thống, cải thiện hiệu quả điều trị.
CRISPR-Cas9 bao gồm sgRNA (single-guide RNA) và nuclease Cas9. Khi được đưa vào tế bào mục tiêu, sgRNA sẽ hướng dẫn nuclease Cas9 đến và cắt vùng DNA mục tiêu; sau đó, đoạn DNA bị cắt sẽ được tế bào sửa chữa (Hình 1). Tuy nhiên, kích thước lớn của Cas9 (160 kDa, 4300 base) và sgRNA (~ 31 kDa, 130 base) là một trở ngại lớn cho các hệ thống vận chuyển hiện nay. Bên cạnh đó, các hệ thống vận chuyển hiện nay thường sử dụng virus để vận chuyển. Điều này có thể gây ra các phản ứng miễn dịch, làm giảm đáng kể sự hấp thu các hệ thống vận chuyển, dẫn đến hiệu suất chỉnh sửa gen thấp. Do đó, mặc dù chỉnh sửa gen CRISPR-Cas9 đã được sử dụng rộng rãi trong nghiên cứu, nhưng việc triển khai lâm sàng vẫn còn khá sơ khai. Để có một liệu pháp điều trị ung thư hiệu quả, cần thiết có một hệ thống vận chuyển mang CRISPR-Cas9 đến các tế bào ung thư mục tiêu một cách chính xác, an toàn và đặc biệt phải có hiệu suất chỉnh sửa gen cao.
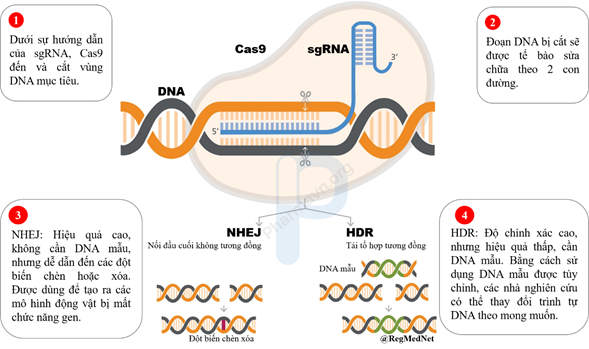
Hình 1: Cơ chế hoạt động của CRISPR-Cas9
CRISPR-LNPs: Mảnh ghép cuối cùng cho liệu pháp điều trị ung thư
Nhằm vận chuyển tối ưu CRISPR-Cas9 tới các tế bào ung thư mục tiêu, nhóm nghiên cứu tại Đại học Tel Aviv đã phát triển một hệ thống vận chuyển mới dựa trên hạt nano lipid (LNP) có thể ion hóa, cho phép đóng gói nucleid acid dễ dàng. Hệ thống này được gọi là CRISPR-LNPs (cLNPs) (Hình 2), giúp mang mRNA Cas9 và sgRNA vào các tế bào ung thư mục tiêu. Tại tế bào mục tiêu, mRNA Cas9 sau đó sẽ được dịch mã thành enzyme Cas9 để hoạt động như một chiếc kéo phân tử cắt vùng DNA mục tiêu của tế bào ung thư dưới sự hướng dẫn của sgRNA, từ đó làm vô hiệu hóa hoàn toàn sự phát triển của tế bào ung thư.

Hình 2: Hệ thống vận chuyển cLNPs
Ở nghiên cứu này, mRNA đã được chọn để vận chuyển thay vì DNA plasmid, nhằm hạn chế chỉnh sửa gen sai mục tiêu. DNA plasmid chứa gen sgRNA và Cas9 thường được sử dụng nhiều trong nghiên cứu do giá thành rẻ và dễ thao tác. Tuy nhiên, vấn đề là DNA plasmid có thời gian tồn tại trong tế bào tương đối dài, lên đến vài tuần. Bởi vì DNA plasmid tồn tại quá lâu, rất nhiều sgRNA và Cas9 sẽ được phiên mã và dịch mã, dẫn đến chúng được biểu hiện liên tục, đây là một vấn đề lớn. Bởi vì sau khi vị trí DNA mục tiêu được chỉnh sữa lần đầu tiên, việc nhắm tới vị trí DNA mục tiêu này lần thứ hai để chỉnh sữa trở thành một điều không thể, thay vào đó nó sẽ nhắm vào các vị trí mà có các trình tự DNA chỉ khác trình tự DNA mục tiêu một vài nucleotide, từ đó có thể dẫn đến các biến đổi có thể gây hại cho các tế bào hoặc sinh vật. Trong khi đó ở mRNA Cas9, khi được đưa vào tế bào sẽ mã hóa thành enzyme Cas9. Quá trình chỉnh sửa gen sẽ hoạt động một thời gian ngắn trước khi enzyme và mRNA bị tế bào tiêu hủy.
Để kiểm tra khả năng chỉnh sửa DNA của cLNPs trong các tế bào ung thư, các nhà nghiên cứu đã chọn gen PLK-1 làm đối tượng chỉnh sửa. PLK-1 là một kinase cần thiết cho quá trình nguyên phân của tế bào. Các nhà nghiên cứu hy vọng rằng việc phá hủy gen PLK-1 sẽ giúp phá vỡ sự phân chia không kiểm soát của tế bào ung thư, gây chết tế bào và do đó ngăn chặn sự phát triển của khối u. Kết quả cho thấy khả năng chỉnh sửa gen của phức hợp sgPLK-1-cLNPs lên đến 98% ở nhiều loại tế bào ung thư (tiến hành trong ống nghiệm), với tỷ lệ chỉnh sửa gen sai mục tiêu <0.1%.
Sau đó, để kiểm tra tính khả thi của việc sử dụng sgPLK-1-LNPs trong điều trị ung thư, các nhà nghiên cứu đã chọn thử nghiệm trên mô hình chuột bị 2 loại ung thư nguy hiểm nhất, đó là u nguyên bào thần kinh đệm và ung thư buồng trứng di căn.
U nguyên bào thần kinh đệm là loại ung thư não nguy hiểm nhất, với thời gian trung bình một người có thể sống sau khi được chẩn đoán là 15 tháng và tỷ lệ sống sót sau 5 năm chỉ có 3%. Các nhà nghiên cứu đã chứng minh rằng một lần điều trị duy nhất với cLNP đã làm tăng gấp đôi tuổi thọ trung bình của những con chuột bị u nguyên bào thần kinh đệm, cải thiện tỷ lệ sống sót tổng thể của chúng lên khoảng 30%.
Ung thư buồng trứng là nguyên nhân hàng đầu gây tử vong ở phụ nữ. Hầu hết bệnh nhân được chẩn đoán ở giai đoạn cuối của bệnh, khi mà di căn đã lan ra khắp cơ thể. Bất chấp những tiến bộ trong những năm gần đây, chỉ có một phần ba số bệnh nhân sống sót sau căn bệnh này. Điều trị bằng cLNP trên mô hình chuột bị ung thư buồng trứng di căn đã làm tăng tỷ lệ sống sót tổng thể của chúng lên 80%.
Ưu điểm của hệ thống phân phối mới cLNPs đó là nó không phải virus, không gây phản ứng miễn dịch, cho hiệu quả chỉnh sửa gen cao (lên đến 98% trong nhiều tế bào ung thư trong ống nghiệm và lên đến 80% trong cơ thể sống), liều lượng hiệu quả tối thiểu thấp, không có độc tính, không có tác dụng phụ, cải thiện khả năng nhắm mục tiêu khối u, từ đó làm tăng độ an toàn.
Tuy nhiên, điều quan trọng mà người đọc cần lưu ý là: những kết quả này là những nghiên cứu sơ bộ trên mô hình động vật và tế bào. Đồng nghĩa với việc khi được thực hiện trên người thì hiệu quả có được như vậy hay không thì vẫn chưa biết được. Ngoài ra, cỡ mẫu của nhóm đối chứng và nhóm bệnh vẫn còn ít, chỉ có tám con chuột cho mỗi nhóm, do đó vẫn cần tiến hành các nghiên cứu trên các cỡ mẫu lớn hơn để xác nhận xem tỷ lệ sống sót có đồng nhất hay không.
Thay lời kết
Theo Giáo sư Dan Peer, trưởng nhóm nghiên cứu: “Đây là nghiên cứu đầu tiên trên thế giới chứng minh rằng chỉnh sửa gen bằng CRISPR/Cas9 có thể điều trị ung thư hiệu quả trên động vật sống. Cần phải nhấn mạnh rằng đây không phải là hóa trị, không hề cho thấy bất kỳ tác dụng phụ nào. Hệ thống vận chuyển CRISPR-LNPs mà nhóm chúng tôi phát triển cho phép nhắm mục tiêu tới các DNA chịu trách nhiệm cho sự sống sót của các tế bào ung thư. Kéo phân tử bằng Cas9 sẽ cắt đứt hoàn toàn các DNA này, từ đó làm vô hiệu hóa và ngăn chặn vĩnh viễn sự nhân lên trở lại của các tế bào ung thư. Đây là một phương pháp điều trị đầy mới mẻ cho các bệnh ung thư nguy hiểm mà hiện nay vẫn chưa có một phương pháp điều trị hiệu quả.”
Nhóm nghiên cứu cũng nhấn mạnh rằng tiềm năng của hệ thống vận chuyển cLNP là rất lớn. Nó hứa hẹn sẽ mở ra nhiều khả năng mới để điều trị nhiều loại ung thư khác nhau cũng như các bệnh di truyền hiếm gặp hay các bệnh mãn tính do virus gây ra (như AIDS).
Về dự định tương lai, giáo sư Dan Peer cho biết thêm: “Ý định kế tiếp của nhóm chúng tôi là tiếp tục tiến hành các thử nghiệm trên các bệnh di truyền thú vị như bệnh ung thư máu hay chứng loạn dưỡng cơ Duchenne. Có thể sẽ mất một khoảng thời gian dài trước khi phương pháp điều trị mới này được sử dụng trên người, tuy nhiên chúng tôi vẫn rất lạc quan. Thông qua Ramot, một công ty chuyển giao công nghệ của TAU, chúng tôi đang đàm phán với các tập đoàn và tổ chức quốc tế, nhằm đem đến cho các bệnh nhân những lợi ích tốt nhất từ việc chỉnh sửa gen.”
Tài liệu tham khảo
- [1] Daniel Rosenblum, etc., 2020, “CRISPR-Cas9 genome editing using targeted lipid nanoparticles for cancer therapy”, Science Advances, https://advances.sciencemag.org/content/6/47/eabc9450, 21/11/2020.
- [2] Genengnews, 2020, “CRISPR Technique Effectively Destroys Metastatic Cancer Cells in Living Animal“, https://www.genengnews.com/news/crispr-technique-effectively-destroys-metastatic-cancer-cells-in-living-animal/, 21/11/2020.
- [3] Jack Dunhill, 2020, “CRISPR-Based Gene Editing Approach Destroys Cancer Cells, Boost Survival From Some Cancers By 80 Percent”, IFLScience, https://www.iflscience.com/health-and-medicine/crisprbased-gene-editing-can-boost-survival-of-some-cancers-by-up-to-80-percent-study-suggests/, 21/11/2020.
- [4] Brittany Enzmann , 2018, “The Problems of Using Plasmids for CRISPR Genome Editing“, SYNTHEGO, https://www.synthego.com/blog/crispr-plasmid-pitfalls, 21/11/2020.
- Hình đai diện từ: https://nuscimag.com/cutting-away-at-the-details-how-crispr-cas-9-revolutionized-science-7467adff097c