[17/11] FDA phê duyệt Tzield (teplizumab-mzwv) – loại thuốc đầu tiên giúp trì hoãn sự khởi phát của ĐTĐ loại 1
Biên dịch: Đỗ Thụy Nhật Hà
Hiệu đính: Ds. Q.Tuyến
Ngày 17/11/2022, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt thuốc tiêm Tzield (teplizumab-mzwv) để trì hoãn sự khởi phát của bệnh tiểu đường loại 1 giai đoạn 3 ở người lớn và bệnh nhi từ 8 tuổi trở lên hiện đang mắc bệnh tiểu đường loại 1 giai đoạn 2.
John Sharretts, M.D., giám đốc Bộ phận Bệnh tiểu đường, Rối loạn Lipid và Béo phì tại Trung tâm Đánh giá Thuốc của FDA cho biết: “Việc phê duyệt một liệu pháp hạng nhất ngày hôm nay đã bổ sung thêm một lựa chọn điều trị mới quan trọng cho một số bệnh nhân có nguy cơ nhất định.” “Tiềm năng của thuốc trong việc trì hoãn chẩn đoán lâm sàng đái tháo đường týp 1 có thể cung cấp cho bệnh nhân từ hàng tháng đến hàng năm mà không có gánh nặng bệnh tật.”
BỆNH HỌC:
Bệnh tiểu đường loại 1 là bệnh xảy ra khi hệ thống miễn dịch tấn công và phá hủy các tế bào tạo ra insulin. Những người được chẩn đoán mắc bệnh tiểu đường loại 1 có lượng glucose tăng cao cần tiêm insulin (hoặc đeo máy bơm insulin) để sống sót và phải kiểm tra lượng đường trong máu thường xuyên trong ngày.
Mặc dù bệnh có thể xuất hiện ở mọi lứa tuổi nhưng bệnh tiểu đường loại 1 thường được chẩn đoán ở trẻ em và thanh niên.
Một người có nguy cơ mắc bệnh tiểu đường loại 1 cao hơn nếu họ có cha mẹ, anh chị em mắc bệnh tiểu đường loại 1, mặc dù hầu hết bệnh nhân mắc bệnh tiểu đường loại 1 không có tiền sử gia đình.
THÔNG TIN THUỐC:
Tzield liên kết với một số tế bào của hệ thống miễn dịch và làm chậm quá trình tiến triển thành bệnh tiểu đường loại 1 giai đoạn 3. Tzield có thể vô hiệu hóa các tế bào miễn dịch tấn công các tế bào sản xuất insulin, đồng thời tăng tỷ lệ các tế bào giúp điều hòa phản ứng miễn dịch.
Tzield được dùng bằng cách truyền tĩnh mạch một lần mỗi ngày trong 14 ngày liên tiếp.
DỮ LIỆU NGHIÊN CỨU:
Tính an toàn và hiệu quả của Tzield đã được đánh giá trong một thử nghiệm ngẫu nhiên, mù đôi, dựa trên sự kiện, có đối chứng với giả dược với 76 bệnh nhân mắc bệnh tiểu đường loại 1 giai đoạn 2.
Trong thử nghiệm, bệnh nhân ngẫu nhiên nhận được Tzield hoặc giả dược một lần mỗi ngày qua truyền tĩnh mạch trong 14 ngày.
Thước đo chính về hiệu quả là thời gian từ khi phân ngẫu nhiên đến khi phát triển chẩn đoán bệnh tiểu đường loại 1 giai đoạn 3.
Kết quả thử nghiệm cho thấy trong thời gian theo dõi trung bình là 51 tháng, 45% trong số 44 bệnh nhân dùng Tzield sau đó được chẩn đoán mắc bệnh tiểu đường loại 1 giai đoạn 3, so với 72% trong số 32 bệnh nhân dùng giả dược.
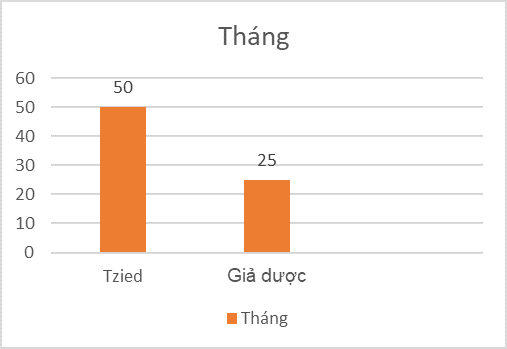
Khoảng thời gian trung bình từ khi phân ngẫu nhiên đến chẩn đoán bệnh tiểu đường loại 1 giai đoạn 3 là 50 tháng đối với những bệnh nhân dùng Tzield và 25 tháng đối với những người dùng giả dược. Điều này thể hiện sự chậm trễ có ý nghĩa thống kê trong sự phát triển của bệnh tiểu đường loại 1 giai đoạn 3.
Thời gian theo dõi trung bình: 51 tháng

Thể hiện sự chậm trễ có ý nghĩa trong sự phát triển của bệnh tiếu đường loại 1 giai đoạn 3
TÁC DỤNG PHỤ CỦA THUỐC:
Các tác dụng phụ phổ biến nhất của Tzield bao gồm giảm mức độ của một số tế bào bạch cầu, phát ban và đau đầu.
Việc sử dụng Tzield đi kèm với các cảnh báo và biện pháp phòng ngừa, bao gồm sự tiền mê và theo dõi các triệu chứng của Hội chứng giải phóng Cytokine; nguy cơ nhiễm trùng nghiêm trọng; giảm mức độ của một loại tế bào bạch cầu gọi là tế bào lympho; nguy cơ phản ứng quá mẫn; sự cần thiết phải thực hiện tất cả các loại vắc-xin phù hợp với lứa tuổi trước khi bắt đầu Tzield; cũng như tránh sử dụng đồng thời vắc xin sống, bất hoạt và vắc xin mRNA với Tzield.
Tzield đã nhận được các chỉ định Đánh giá Ưu tiên và Liệu pháp Đột phá cho chỉ định này.
FDA đã phê duyệt Tzield cho Provention Bio.
TLTK: