Ứng viên vaccine Herpes mới nhiều hứa hẹn
Biên dịch: Nguyễn Thái Minh Trận
Vắc-xin sống, giảm độc lực mới sử dụng vi rút Herpes được chỉnh sửa gen đã cho thấy tiềm năng vượt trội hơn loại ứng cử viên vắc-xin Herpes dẫn đầu hiện nay trong một nghiên cứu tiền lâm sàng.
Sơ lược về Herpes
Theo Tổ chức Y tế Thế giới, ước tính có hơn 3,7 triệu người trên thế giới mắc bệnh Herpes. Đây là một căn bệnh nhiễm trùng được gây ra bởi vi rút Herpex Simplex (HSV) loại I (HSV-1) hoặc vi rút HSV loại II (HSV-2). Các triệu chứng của bệnh bao gồm xuất hiện mụn rộp ở quanh miệng hoặc vùng sinh dục, nặng có thể gây mù lòa hoặc viêm não cũng như các bệnh nhiễm trùng nghiêm trọng khác ở những người bị suy giảm miễn dịch. Bởi vì hiện tại vẫn chưa có một phương pháp chữa trị triệt để nên một khi bị mắc Herpes, người bệnh phải sống với nó suốt phần đời còn lại. Điều này đã để lại những hậu quả nặng nề về thể chất và tinh thần cho người bệnh cũng như làm tăng nguy cơ lây nhiễm HIV trong xã hội.
Bất chấp sự phổ biến của HSV, trải qua hơn bốn thập kỷ nghiên cứu, cho tới hiện nay vẫn chưa có một loại vắc-xin nào được chấp thuận cho HSV. Một trong những nguyên nhân quan trọng dẫn đến điều này là bởi vì HSV có các cơ chế đặc biệt tinh vi giúp nó lẩn tránh khỏi hệ miễn dịch. Do đó, việc phát triển vắc-xin hiệu quả cho HSV đã luôn là một ưu tiên hàng đầu nhưng đầy thách thức cho các nhà nghiên cứu.
(Để hiểu thêm về Herpes cũng như các cơ chế trốn tránh miễn dịch của nó, vui lòng đọc: https://pharmavn.org/dot-pha-trong-dieu-tri-benh-herpes-voi-ky-thuat-chinh-sua-gene.html)
Giải mã Vắc-xin Herpes mới – Vắc-xin R2
Hầu hết các thử nghiệm lâm sàng gần đây đã sử dụng vắc-xin tiểu đơn vị (subunit vaccine) chứa glycoprotein trên bề mặt HSV, đặc biệt là glycoprotein D của HSV-2 (gD2), để làm kháng nguyên tạo miễn dịch. Mặc dù, các thử nghiệm lâm sàng này đã cho thấy vắc-xin tiểu đơn vị gD2 giúp bảo vệ phụ nữ khỏi sự lây nhiễm của HSV-1, tuy nhiên, chúng lại không thể ngăn chặn sự lây nhiễm của HSV-2. Điều này có thể là do vắc-xin tiểu đơn vị chỉ giúp hệ miễn dịch nhận ra một phần của HSV và bỏ sót những thành phần khác. Từ đó dẫn đến mối quan tâm mới đối với vắc-xin HSV sống, giảm độc lực – loại vắc-xin giúp trình diện nhiều kháng nguyên HSV hơn cho hệ miễn dịch.
Thông thường, HSV sẽ lây nhiễm bắt đầu ở bề mặt da, nhưng sẽ nhanh chóng di chuyển dọc theo các sợi dây thần kinh để tới và chiếm đóng các tế bào thần kinh. Để tạo được vắc-xin HSV sống, giảm độc lực, cần thiết sử dụng chủng HSV được loại bỏ cơ chế giúp chúng di chuyển tới các tế bào thần kinh, nhằm hạn chế các lo ngại về việc chủng HSV sống, giảm độc lực trong vắc-xin sau khi được tiêm vào sẽ sống tiềm ẩn và tấn công lại vào hệ thần kinh của người được tiêm. Điều này có thể dễ dàng được thực hiện bằng cách tạo ra các đột biến gây suy yếu trên diện rộng. Tuy nhiên, nó cũng đồng thời làm suy giảm khả năng nhân lên của HSV, dẫn đến mất khả nặng nhận được một phản ứng miễn dịch mạnh mẽ mà có thể bảo vệ cơ thể khỏi những đợt truyền nhiễm HSV trong tương lai.
Một nhóm các nhà nghiên cứu của đại học Nebraska, Northwestern, và Tufts đã dành nhiều năm nghiên cứu để giải quyết vấn đề này. May mắn đã đến với họ khi nhóm thành công phát hiện ra protein alpha-herpesvirus, hay còn gọi là pUL37, đóng vai trò quan trọng giúp HSV di chuyển dọc theo dây thần kinh để tới các tế bào thần kinh. Từ đó, nhóm nghiên cứu đã tạo ra vắc-xin sống, giảm độc lực R2 sử dụng chủng HSV-1 có vùng 2 (R2) mã hóa protein pUL37 được sửa đổi và đem thử nghiệm hiệu quả lên chuột. Kết quả cho thấy chủng HSV-1 này có khả năng nhân lên như bình thường, từ đó biểu hiện đầy đủ toàn bộ kháng nguyên HSV giúp tạo một hệ miễn dịch mạnh mẽ. Bên cạnh đó, chủng HSV-1 này cũng không thể xâm nhập các tế bào thần kinh để hình thành bệnh nhiễm trùng suốt đời do chúng đã bị mắc kẹt ở đầu cuối dây thần kinh, từ đó ngăn chặn nguy cơ tiềm ẩn gây biến chứng thần kinh mà các vắc-xin HSV sống, giảm độc lực trước đây bị mắc phải.
Bác sĩ David Bernstein, người đánh giá các ứng viên vắc-xin Herpes thông qua một chương trình được hỗ trợ bởi Viện Y tế Quốc gia, đã liên hệ với nhóm để kiểm tra hiệu quả của vắc-xin R2 trong việc ngăn chặn sự lây nhiễm HSV-2 ở bộ phận sinh dục chuột lang (Hình 1). Kết quả cho thấy chỉ 1 trong 12 con chuột lang được tiêm vắc-xin R2 phát triển các tổn thương cấp tính sau khi bị lây nhiễm HSV-2, so với 5 trong 12 con chuột lang được tiêm vắc-xin tiểu đơn vị gD2 mà đã thất bại trong thử nghiệm lâm sàng gần đây. Và trong khi vắc-xin tiểu đơn vị gD2 không có ảnh hưởng rõ rệt đến số ngày mà chuột lang phát tán vi rút (viral shedding), vắc-xin R2 đã làm giảm thời gian phát tán vi rút từ 29 ngày xuống còn khoảng 13 ngày. Đặc biệt, việc phát tán vi rút định kỳ đã giảm từ 33-64% ở nhóm được tiêm R2. Điều này có ý nghĩa đặc biệt quan trọng vì phát tán vi rút định kỳ là phương tiện lây truyền HSV chính. Ngoài ra, những con chuột lang này cũng không có dấu hiệu của HSV-2 trong các cụm tế bào não mà thường chứa HSV-2. Các kháng thể trung hòa được ghi nhận ở chuột lang được tiêm vắc-xin R2 cao hơn khoảng ba lần so với những con được tiêm vắc-xin tiểu đơn vị gD2. Các nhà khoa học nhận xét rằng: “Đây là một vắc-xin đầy hứa hẹn cho HSV”.
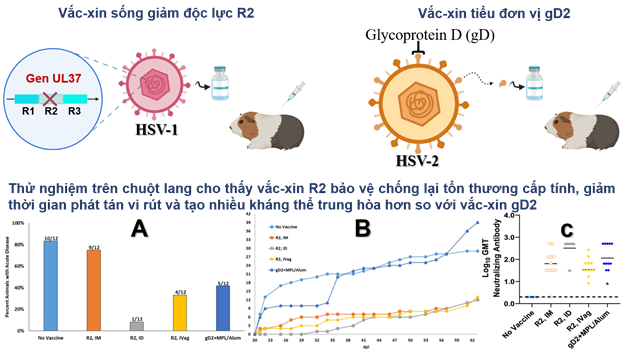
Hình 1: Kết quả thử nghiệm vắc-xin R2 và gD2 trên chuột lang. (A) Phần trăm chuột lang phát triển tổn thương sinh dục cấp tính; số lượng chuột lang được chỉ ra trên mỗi cột (B) Số ngày phát tán vi rút tích lũy (C) Độ chuẩn kháng thể trung hòa HSV-2 được tạo ra sau ba lần tiêm chủng nối tiếp
Như vậy, ưu điểm của Vắc-xin R2 đó là nó đã phá vỡ một số vấn đề cứng đầu đã xảy ra với các loại vắc-xin trước đó, như vắc-xin tiểu đơn vị không trình diện đầy đủ kháng nguyên HSV, vắc-xin sống, giảm động lực chứa chủng HSV chỉ nhân lên được một lần hay chủng HSV quá yếu để hoạt động tốt và do đó ngăn chặn sự hình thành một hệ miễn dịch mạnh mẽ. Vắc-xin R2 không chỉ hạn chế các nguy cơ tiềm ẩn gây biến chứng hệ thần kinh mà còn có khả năng trình bày đầy đủ kháng nguyên của HSV giúp đem lại một hệ miễn dịch mạnh mẽ, đồng thời nó cũng để lại ít tổn thương trên bộ phận sinh dục, hạn chế việc lây truyền vi rút và gây ra nhiều kháng thể trung hòa, góp phần ngăn chặn sự lây truyền HSV-2 hơn so với ứng cử viên vắc-xin tiểu đơn vị gD2 khi được thử nghiệm trên chuột lang.
Với việc vắc-xin R2 chứa chủng HSV-1 cho thấy khả năng bảo vệ chéo đầy hứa hẹn chống lại HSV-2, các nhà nghiên cứu đặt mục tiêu phát triển và thử nghiệm vắc-xin R2 chứa chủng HSV-2 giúp chống lại HSV-2. Nhóm nghiên cứu chỉ ra rằng: “Nếu bạn đang tạo ra kháng thể chống lại protein của một loại vi rút cụ thể, thì nó sẽ hoạt động tốt hơn so với việc bạn tạo ra kháng thể để chống lại một vi rút khác. Vì vậy, đó là kỳ vọng của chúng tôi.”
Ứng dụng cho ngành công nghiệp chăn nuôi
Vào khoảng thời gian Bác sĩ Bernstein bày tỏ sự quan tâm đến vắc-xin R2, 2 thành viên của nhóm nghiên cứu, Tiến sĩ Pickard và Smith, đã khởi động một công ty khởi nghiệp tên là Thyreos để phát triển và thương mại hóa vắc-xin vi rút sống, giảm độc lực được sủa đổi vị trí R2. Công ty đang nghiên cứu các loại vắc-xin dành cho vật nuôi, đặc biệt là bò và lợn, có khả năng chống lại vi rút nhóm alpha-herpesvirus, là nguyên nhân gây ra bệnh đường hô hấp, hạn chế sự thèm ăn ở vật nuôi, góp phần gây thất thu hàng tỷ đô la hàng năm. Mặc dù vắc-xin sống, giảm độc lực ngừa alpha-herpesvirus cho vật nuôi hiện tại đã có, nhưng chúng vẫn xuất hiện tình trạng vi rút sống, giảm độc lực được tiêm vào vật nuôi sống tiềm ẩn và xâm nhập vào hệ thần kinh.
Theo Tiến sĩ Pickard: “Vấn đề ở vật nuôi cũng có thể dễ dàng giải quyết như ở người. Điều gì sẽ xảy ra khi những con bò được chất lên một chiếc xe tải và được vận chuyển đến một bãi chăn nuôi, đó là một môi trường căng thẳng. Vi rút ẩn náu trong hệ thống miễn dịch sẽ hoạt động trở lại. Chúng sẽ bắt đầu phóng thích vi rút theo chất bài tiết từ mũi, và sau đó truyền vi rút đó cho các con bò khác dẫn đến bị bệnh đường hô hấp. Vì vậy, chủng vi rút được sửa đổi của chúng tôi không thể xâm nhập vào hệ thần kinh không chỉ là một lý thuyết suông. Thực ra, nó có một ứng dụng rất thực tế cho ngành chăn nuôi gia súc.”
Trên thực tế, nhóm đã phát triển vắc-xin R2 cho vi rút alphaherpesvirus pseudorabies (PrV) gây bệnh truyền nhiễm giả dại (Pseudorabies) ở lợn, và Pickard cũng bày tỏ sự tin tưởng vào lời hứa rằng vắc-xin này sẽ giúp bảo vệ đàn lợn. Mặc dù, trong suốt những năm 1990 và đầu những năm 2000, một chiến dịch lớn của Hoa Kỳ đã thành công trong việc diệt trừ bệnh giả dại ra khỏi đất nước – phần lớn thông qua tiêm chủng vắc-xin, tuy nhiên, loại vắc-xin này vẫn có thể gây xâm nhập vào hệ thần kinh của lợn và đã được chứng minh là ít thành công hơn ở các quốc gia mà ít cảnh giác về bệnh giả dại.
“Một lần nữa, chúng tôi khá tự tin rằng vắc-xin R2 cho PrV của chúng tôi sẽ hiệu quả hơn những vắc-xin hiện có.”, Tiến sĩ Pickard bổ sung thêm, “Về mặt bảo vệ đàn lợn, nó sẽ có tác động lớn vào một thời điểm nào đó. Những mầm bệnh này có thể tồn tại trong quá trình vận chuyển xuyên Thái Bình Dương trong nguyên liệu thức ăn chăn nuôi hoặc sản phẩm thức ăn chăn nuôi. Khi bạn nói chuyện với những người quan tâm đến an toàn sinh học, họ nói rằng bất cứ điều gì đang xảy ra ở những nơi khác trên thế giới liên quan đến những loại virus này, cuối cùng, chúng có thể xuất hiện ở đây. Nó chỉ là một vấn đề thời gian.”
Tài liệu tham khảo
- University of Nebraska-Lincoln, 2020, “Vaccine shows promise against herpes virus”, ScienceDaily, https://www.sciencedaily.com/releases/2020/11/201106093014.htm, 3/1/2020.
- Bernstein, D.I., et al., The R2 non-neuroinvasive HSV-1 vaccine affords protection from genital HSV-2 infections in a guinea pig model. npj Vaccines, 2020. 5(1): p. 104.
- Danielle Reiter, 2020, “Herpes Vaccine Candidates Have Alternative Approaches”, Precision Vaccinations, https://www.precisionvaccinations.com/herpes-vaccine-candidates-have-alternative-approaches, 3/1/2020.
- Ảnh đại diện từ: Kateryna Kon/Science Photo Library/Getty Images