Lần đầu tiên chất thoái hóa protein trúng đích được thử nghiệm lâm sàng
Tác giả: Nguyễn Thái Minh Trận
Mentor: Võ Đức Duy, Ph.D.
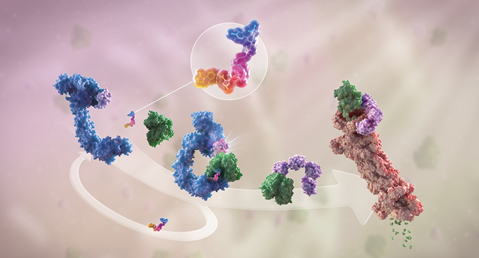
Hình 1. Chất thoái hóa protein (nhiều màu, phía trên) giúp liên kết protein gây bệnh (xanh lá cây) với enzyme E3 ubiquitin ligase (xanh dương) để tạo thành một phức hợp. Sau đó, enzyme E3 tuyển dụng thêm vài enzyme liên hợp ubiquitin[1] (còn được gọi là enzyme E2) và bắt đầu quá trình ubiquitin hóa[2] bằng cách chuyển các ubiquitin trên enzyme E2 sang protein gây bệnh để tạo chuỗi ubiquitin (màu tím). Chuỗi ubiquitin này giúp phát tín hiệu cho proteasome[3] (màu đỏ) nhận diện và phân giải protein gây bệnh thành các amino acid. Chất thái hóa protein sau đó tách rời khỏi phức hợp và bắt đầu lại vòng lặp.
Điều trị ung thư luôn là một tham vọng to lớn mà nhân loại muốn đạt được. Trong nhiều thập kỷ qua, liệu pháp trúng đích sử dụng chất ức chế phân tử (small-molecule inhibitor) đã trở thành một trong những cách thành công nhất để đạt được điều này. Với kích thước phân tử nhỏ, chất ức chế phân tử có khả năng xâm nhập màng sinh chất để nhắm mục tiêu tới các thụ thể trên bề mặt tế bào chất và các protein nội bào, bao gồm các protein ức chế sự tự hủy (anti-apoptotic proteins) đóng vai trò chính trong việc truyền tín hiệu cho sự phát triển của tế bào và thúc đẩy di căn. Tuy nhiên, phương pháp này vẫn còn mang các hạn chế. Thứ nhất, các chất ức chế phân tử được thiết kế để bám dính vào vị trí hoạt động và khóa chức năng của các protein mục tiêu, do đó chúng bị giới hạn phạm vi hoạt động. Và thực tế, phần lớn các protein của con người thường thiếu vị trí hoạt động hoặc có vị trí hoạt động nhưng lại rất khó để một phân tử khác gắn vào. Các protein này trở thành thách thức lớn cho các loại thuốc trúng đích hiện nay và được mô tả với thuật ngữ “undraggable”. Thứ hai, nồng độ thuốc luôn phải duy trì cao hơn so với nồng độ protein mục tiêu và các tế bào ung thư sẽ đề kháng thuốc bằng cách làm tăng sản xuất protein mục tiêu. Thứ ba, hầu hết các loại thuốc ức chế phân tử thường có tuổi thọ ngắn và do đó đòi hỏi sử dụng liều thuốc hàng ngày. Thứ tư, tiếp xúc liên tục với các chất ức chế phân tử sẽ gây đột biến trên protein mục tiêu, dẫn đến chất ức chế phân tử có thể mất khả năng liên kết vị trí hoạt động và do đó gây sự kháng thuốc.
Một ví dụ về “undruggable” là protein MDM2 có khả năng làm ức chế hoạt động hoặc thoái hóa protein p53. Protein p53 được biết đến như người bảo vệ bộ gen bằng cách kích hoạt sự ngừng phân chia tế bào khi có sự đột biến gen phát sinh. Khoảng thời gian ngừng phân chia tế bào sẽ được sử dụng cho sửa chữa bộ gen trong tế bào và nếu cấu trúc bộ gen không thể sửa chữa được nữa thì p53 sẽ kích hoạt sự tự hủy ở các tế bào này. Vì vậy, p53 được xem là tuyến đầu phòng chống ung thư.
Các tế bào ung thư sẽ chống lại các protein p53 bằng cách sản xuất quá mức protein MDM2 có khả năng liên kết với p53 và ngăn không cho p53 thực hiện công việc của mình. Vì vậy, nếu có một phương pháp ức chế hoặc phá hủy MDM2 trước khi nó gắn vào p53 thì các tế bào ung thư sẽ bị tự hủy dưới tác động của p53. Tuy nhiên, vùng hoạt động của MDM2 rất khó để các chất ức chế phân tử gắn vào và gây bất hoạt. Đó là lý do MDM2 được gọi là protein “undruggable”.
Để khắc phục các hạn chế của chất ức chế phân tử, một khái niệm mới lạ đã được đưa ra với tên gọi là chất thoái hóa protein (protein degrader). Arvinas được xem là công ty dẫn đầu trong lĩnh vực này thông qua việc phát triển kỹ thuật sinh học PROTAC (PROteolysis TArgeting Chimera). PROTAC là một chất thoái hóa protein có 2 đầu ái lực cao giúp liên kết protein mục tiêu với enzyme E3 ubiquitin ligase và do đó kích hoạt sự tiêu hủy của protein mục tiêu thông qua proteasome (Hình 1). Phương pháp này đã đem tới các lợi thế tuyệt vời. Thứ nhất, về mặt lý thuyết, các chất thoái hóa protein có thể bám vào mọi ngóc ngách trên bề mặt protein mục tiêu để kích hoạt sự thoái hóa, cho thấy tính vượt trội hơn các chất ức chế phân tử. Vì vậy, phương pháp này hứa hẹn sẽ giải quyết các protein “undruggable”. Thứ hai, nhờ đặc tính phân ly khỏi protein mục tiêu sau khi thúc đẩy quá trình thoái hóa thành công và tái liên kết với các protein mục tiêu khác của chất thoái hóa protein, thuốc sử dụng kỹ thuật PROTAC có thể hoạt động với liều lượng thấp, chống lại được sự đề kháng thuốc của tế bào ung thư và hạn chế các tác dụng phụ tiềm ẩn. Thứ ba, tác dụng của các chất ức chế phân tử sẽ biến mất khi thuốc bị đào thải khỏi cơ thể, trong khi đó nhờ cơ chế phá hủy protein gây bệnh hoàn toàn của chất thoái hóa protein, sẽ mất rất lâu để nồng độ protein gây bệnh phục hồi và hoạt động trở lại và do đó mang lại hiệu quả điều trị bền vững. Thứ năm, trong một số trường hợp, các thuốc sử dụng kỹ thuật PROTAC đã cho thấy khả năng liên kết được ngay cả các protein mục tiêu bị thay đổi cấu trúc mà tế bào ung thư tạo ra như một cơ chế đề kháng. Ngoài ra, chất thoái hóa protein cũng mang những đặc tính dược học thông thường như: hòa tan tốt, sử dụng được dưới dạng thuốc dùng qua đường miệng, xâm nhập được vào các tế bào, chống lại các quá trình trao đổi chất trong cơ thể và trong một số trường hợp có thể vượt qua hàng rào máu não. Vì vậy, chúng có thể dễ dàng tối ưu thành các loại thuốc sinh học hiệu quả sử dụng được qua đường miệng. Tuy nhiên, chất thoái hóa protein chỉ có thể bám vào các protein khi trên bề mặt của chúng có chứa các phối tử (ligand)[4], và thực tế vẫn có một lượng lớn protein không hề có phối tử. Do đó, xác định các protein gây bệnh trên con người tồn tại phối tử là việc mà các công ty đi đầu trong lĩnh vực này đang hướng tới.
Mặc dù kỹ thuật PROTAC cho thấy một cách tiếp cận rất hứa hẹn và mạnh mẽ để vượt qua rào cản ung thư, tuy nhiên vẫn cần rất nhiều nỗ lực để có được cái nhìn sâu sắc hơn về hiệu quả và sự an toàn của thuốc sử dụng kỹ thuật PROTAC khi được đưa vào phòng khám. Hiện tại, Arvinas là công ty đầu tiên đưa chất thoái hóa protein vào thử nghiệm lâm sàng trên con người, với 2 loại thuốc: ARV-110 với mục tiêu là thụ thể Androgen (AR-Androgen receptor) trong ung thư tuyến tiền liệt và ARV-471 với mục tiêu là thụ thể Oestrogen (ER-Oestrogen receptor) trong ung thư vú. Các kết quả đầu tiên của giai đoạn thử nghiệm 1/2 trên loại thuốc ARV-110 đã cho thấy sự suy giảm AR ở những bệnh nhân nam ung thư tuyến tiền liệt kháng thiến di căn (mCRPC-metastatic Castration-Resistant Prostate Cancer), bằng chứng xác nhận tính hiệu quả của thuốc sử dụng kỹ thuật PROTAC. Khi các thử nghiệm này kết thúc, chúng ta sẽ có được một bức tranh toàn cảnh về cách thức hấp thu, phân phối, chuyển hóa và bài tiết ra khỏi cơ thể của loại thuốc này cũng như liệu chúng có đáp ứng các yêu cầu đối với một loại thuốc dùng qua đường miệng hay không.
Nguồn: Nature Reviews Drug Discovery 18, 237-239 (2019). https://www.nature.com/articles/d41573-019-00043-6
[1]Ubiquitin: là một loại protein nhỏ được tìm thấy trong hầu hết các mô tế bào ở người và các sinh vật nhân chuẩn khác. Chức năng nổi bật nhất của ubiquitin là đánh dấu các protein không cần thiết hoặc bị hư hỏng cho quá trình tiêu hủy trong bộ máy phân hủy protein (proteasome). Bên cạnh chức năng này, ubiquitin cũng kiểm soát độ bền, chức năng và sự định vị nội bào của nhiều loại protein.
[2]Ubiquitin hóa (Ubiquitination): là sự biến đổi sau dịch mã của một protein bằng cách gắn một hay nhiều ubiquitin vào protein này. Thông thường, ubiquitin liên kết với protein mục tiêu bằng một liên kết isopeptid giữa nhóm COO− của glycine trên ubiquitin với nhóm ε-NH3+ của lysine trên protein mục tiêu.
[3]Proteasome: là phức hợp protein nằm trong nhân và tế bào chất của tế bào nhân thực. Chức năng chính của proteasome là tiêu hủy các protein bị hư hỏng hoặc thừa với khả năng đặc hiệu cao nhờ hệ thống ubiquitin-proteasome.
[4]Phối tử (ligand): là một phân tử có khả năng liên kết với các phân tử khác, như enzyme hoặc protein, để tạo thành một phức hợp lớn hơn (trong thuật ngữ sinh hóa và dược học). Nghiên cứu phối tử cũng như khả năng liên kết của phối tử đóng vai trò quan trọng trong ngành công nghiệp dược phẩm, đặc biệt là trong thiết kế thuốc dựa trên phối tử (ligand-based drug design).