FDA phê duyệt melphalan flufenamide điều trị bệnh đa u tủy tái phát hoặc khó chữa
Biên dịch: DS. Lâm Trịnh Diễm Ngọc
CHỈ ĐỊNH
Ngày 26/02/2021, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt PEPAXTO® (melphalan flufenamide, còn được gọi là melflufen), kết hợp với dexamethasone trong điều trị đa u tủy (multiple myeloma, MM) dai dẳng hoặc tái phát ở người lớn, mà những bệnh nhân này đã được điều trị với ít nhất bốn liệu pháp điều trị ưu tiên trước đó và có tình trạng kháng ít nhất một chất ức chế proteasome.
Liều khuyến cáo của melphalan flufenamide là 40 mg tiêm tĩnh mạch trong 30 phút vào ngày 1 của mỗi chu kỳ điều trị 28 ngày, kết hợp với dexamethasone.
PEPAXTO là dạng liên hợp thuốc-peptide chống ung thư đầu tiên được FDA chấp thuận.
CƠ CHẾ
Melphalan flufenamide là một thuốc alkyl hóa liên hợp với peptide. Nhờ tính thân dầu, melphalan flufenamide được vận chuyển thụ động vào tế bào, sau đó bị enzym thủy phân thành melphalan.
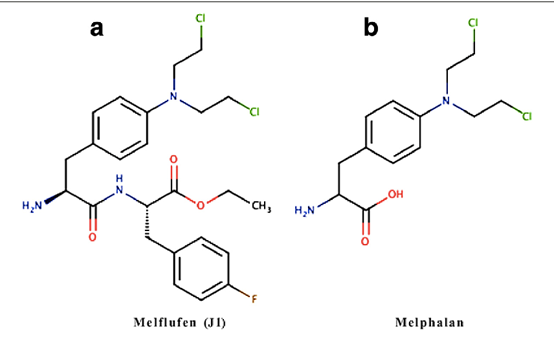
Tương tự các thuốc mù tạt nitơ khác, hoạt tính chống khối u của melphalan flufenamide liên quan đến liên kết chéo của DNA.
Trong thử nghiệm tế bào, melphalan flufenamide ức chế sự tăng sinh và gây chết tế bào máu và khối u theo chương trình (apoptosis).
Ngoài ra, melphalan flufenamide còn hiệp đồng với dexamethasone cho tác dụng gây độc các dòng tế bào đa u tủy kháng và không kháng melphalan.
TÍNH AN TOÀN VÀ HIỆU QUẢ
Hiệu quả và tính an toàn được đánh giá trong nghiên cứu HORIZON (NCT02963493):
Thiết kế: pha II, đa trung tâm, đơn nhóm.
- Đối tượng: 157 bệnh nhân mắc đa u tủy xương tái phát hoặc dai dẳng, đã được điều trị trước đó với tiên lượng xấu
- Điều trị: Tiêm 40mg melphalan flufenamide vào ngày 1 và uống 40mg dexamethasone (20 mg cho bệnh nhân ≥75 tuổi) vào ngày 1, 8, 15 và 22 của mỗi chu kỳ 28 ngày; cho đến khi bệnh tiến triển hoặc có độc tính không thể chấp nhận được.
Kết quả:
- Tỷ lệ đáp ứng chung: 23,7% (KTC 95%: 15,7, 33,4)
- Thời gian đáp ứng trung bình: 4,2 tháng (KTC 95%: 3,2, 7,6)
- Tính an toàn: Các phản ứng có hại thường gặp (> 20%) là mệt mỏi, buồn nôn, tiêu chảy, sốt và nhiễm trùng đường hô hấp. Các chỉ số xét nghiệm bất thường thường gặp (≥50%) là giảm bạch cầu, tiểu cầu, tế bào lympho, bạch cầu trung tính và hemoglobin; tăng creatinin.
Tính an toàn và hiệu quả của melphalan flufenamide chưa được thiết lập để sử dụng như một phác đồ điều trị ở bệnh nhân được cấy ghép.
TLTK:
- https://www.fda.gov/drugs/drug-approvals-and-databases/fda-grants-accelerated-approval-melphalan-flufenamide-relapsed-or-refractory-multiple-myeloma
- https://www.oncopeptides.com/en/media/press-releases/fda-approves-oncopeptides-pepaxto–melphalan-flufenamide-for-patients-with-relapsed-or-refractory-multiple-myeloma?fbclid=IwAR1clJSQKjc0RElD_wsllxC0TN3yaVwGlQjM494xe_6qzuUdQzKPU9BcuOU
- https://www.oncopeptides.com/contentassets/a6783cb36a194c2fa467a8202605f5d3/fda-pepaxto-approval-webcast-presentation.pdf
- Hình đại diện từ: https://www.webmd.com/cancer/multiple-myeloma/ss/slideshow-multiple-myeloma