Sử dụng ‘phage display’ chế tạo peptide đường uống
Tác giả: Trương Hoàng Thiện
Mentor: Võ Đức Duy, Ph.D.
Phát triển thuốc gốc Peptide cho dược phẩm đường uống thông qua phương pháp cải tiến sử dụng thể hiển thị phage (phage display).
Việc lựa chọn các dạng peptide cầu đôi thông qua hiển thị trong pha cận lâm sàng (cụ thể là in vitro) mang lại các peptide tuần hoàn được tối ưu hóa cho tính đặc hiệu điều trị cao và cho sự ổn định chống lại các protease (một loại enzyme phân hủy protein) đường tiêu hóa.
Việc cung cấp các peptide trị liệu thông qua đường uống vẫn là một thách thức lớn đối với ngành dược phẩm. Dược phẩm thông qua đường uống là con đường thuận tiện nhất, vì nó dẫn đến sự tuân thủ điều trị của bệnh nhân cao hơn so với tiêm và đối với một số bệnh mãn tính, việc áp dụng điều trị sớm hơn. Tuy nhiên, hơn 90% peptide trị liệu được phê duyệt (thường được xác định là có ít hơn 50 axit amin) phải được tiêm dưới da hoặc tiêm bắp. Các peptide điều trị bằng đường uống (như linaclotide và plecanatide, được sử dụng để điều trị táo bón trong số các điều kiện khác) được thiết kế để chuyển cục bộ đến đường tiêu hóa (GI) hoặc đến lưu thông toàn thân (như trường hợp của desmopressin, để điều trị polyuric điều kiện, cyclosporine, để ngăn chặn thải ghép nội tạng, để điều trị bệnh tiểu đường loại 2). Các peptide để cung cấp qua đường miệng cần phải ổn định trong môi trường pH động của đường tiêu hóa, và kháng các peptidase dạ dày và tuyến tụy. Ngoài ra, để các peptide được vận chuyển bằng đường uống đến được lưu thông máu, chúng cần phải vượt qua hàng rào chất nhầy GI và biểu mô GI, sống sót qua quá trình chuyển hóa biểu mô GI và sau khi lưu thông, chống lại sự trao đổi chất qua gan.Việc cung cấp peptide bằng đường uống vào đường tiêu hóa có thể được tăng cường thông qua lớp phủ ruột (ở dạng viên hoặc dạng viên nang). Để đưa peptide dùng đường uống vào tuần hoàn máu, các chất tăng cường thẩm thấu ruột, chất mang hạt nano và các thiết bị giống như ống tiêm kích thước micro đã được sử dụng. Hóa dược cũng có thể giúp cải thiện tính ổn định của peptide và tính thấm của biểu mô trong đường GI thông qua các axit amin N-methyl hóa ổn định, cấu trúc tuần hoàn và ghim (liên kết cộng hóa trị giữa hai chuỗi bên axit amin), đồng thời đảm bảo rằng ái lực với mục tiêu thụ thể được duy trì.
Heinis và các đồng tác giả đã sử dụng các thể phage ổn định protein để tạo ra một tập hợp các peptide bị ràng buộc hai cầu sẽ còn nguyên vẹn trong các xét nghiệm sinh học in vitro tiêu chuẩn, và một bước lựa chọn tiếp theo sử dụng dịch đường ruột mô phỏng (SIF) có chứa một nhóm protease huyết thanh tụy các enzyme ở dạng pancreatin (Hình 1). Bước đầu tiên sàng lọc các phage để hiển thị các peptide ổn định hai cầu trên protein của phage – do đó tránh sự biến đổi của sáu cysteine hình thành cầu nối disulfide đã có trong thể phage – để giữ sự xâm nhiễm của phage. Điều này đạt được bằng cách sử dụng áp lực chọn lọc của quá trình khử và chu kỳ hóa học với các liên kết để tạo ra các peptide thắt nút, ổn định. Phương pháp này mang lại một thư viện các peptide cầu đôi ổn định trong SIF chứa nồng độ peptidase vừa phải.Sau đó, các tác giả đã đưa việc ổn định kháng peptidase vào các thụ thể đích được chọn để xác định các phối tử có ái lực nano.
Mục tiêu điều trị đầu tiên được lựa chọn là yếu tố đông máu XIa (FX1a), một loại protease có khả năng bị ức chế bởi các thuốc chống huyết khối có nguy cơ gây xuất huyết thấp.
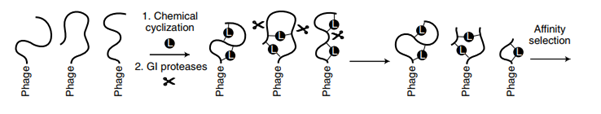
Hình 1 | Phương pháp hiển thị phage của các chuỗi peptide tối ưu hóa các ứng cử viên peptide cầu đôi để kháng lại các protease GI trong khi duy trì ái lực cao và tính đặc hiệu cho các mục tiêu điều trị. Cách tiếp cận này kết hợp sự phát triển của các peptide ổn định bằng cách sử dụng phage tuần tự chống lại mức độ tăng áp suất protease và tối ưu hóa hóa dược để tạo ra các ứng cử viên vĩ mô. L, chỉ ra các liên kết hóa học làm cầu nối các cặp cysteine cysteine; biểu tượng cắt kéo cho thấy sự phân tách bởi các protease ruột.
Mục tiêu thứ hai là thụ thể interleukin (IL) -23 ở niêm mạc đại tràng, một thụ thể được biểu hiện quá mức trong mô GI từ những bệnh nhân mắc bệnh viêm ruột. Thay vì tập trung vào việc thúc đẩy tính kháng GI, các xét nghiệm hiển thị phage được sử dụng để phát triển các peptide có sẵn bằng miệng đã có xu hướng tập trung vào việc chống lại các phối tử trên các thụ thể (enterocyte) GI để phân lập các chuỗi có thể được sử dụng để nhắm mục tiêu. Trong nghiên cứu của Heinis và đồng tác giả, tính kháng peptidase đặc biệt cao có thể dần dần được xây dựng thành các peptide bị hạn chế bắt nguồn từ xét nghiệm hiển thị phage. Như các tác giả đã thảo luận, những cải tiến về tính thấm GI có thể được thiết kế thêm ở các ứng cử viên vĩ mô bằng cách sử dụng điện tích và giảm diện tích bề mặt cực như một phần của phương pháp hóa dược. Điều này minh họa cách các kỹ thuật xây dựng peptide đường uống có thể được kết hợp với hóa dược để tăng cường hơn nữa tính thấm và cải thiện sinh khả dụng đường uống. Các yếu tố cụ thể của cấu trúc tuần hoàn ảnh hưởng đến sinh khả dụng đường uống có thể được nghiên cứu bằng cách kiểm tra cấu trúc mối quan hệ tính thấm của các ứng cử viên peptide bằng cách sử dụng từ thông qua màng nhân tạo, sau đó là nghiên cứu in vivo (trên động vật) trên chuột.
Nhìn chung, sự tiến hóa và lựa chọn peptide dựa trên hiển thị phage có khả năng tăng tốc độ tạo ra các ứng cử viên peptide bằng đường uống để điều trị các bệnh về đường tiêu hóa, bao gồm bệnh viêm ruột, nhiễm trùng GI và ung thư ruột kết.
♦ Phage display Hiển thị phage là một kỹ thuật trong phòng thí nghiệm để nghiên cứu sự tương tác giữa protein-protein, protein-peptide và protein-DNA sử dụng thực khuẩn thể (vi rút lây nhiễm vi khuẩn) để kết nối protein với thông tin di truyền mã hóa chúng. Trong kỹ thuật này, một gen mã hóa protein mong muốn được chèn vào gen protein vỏ của phage, khiến phage “hiển thị” protein ở bên ngoài trong khi chứa gen của protein ở bên trong, dẫn đến kết quả tiếp nối giữa kiểu gen và kiểu hình. Các phage hiển thị này sau đó có thể được sàng lọc dựa trên các protein, peptit hoặc trình tự DNA khác, để phát hiện sự tương tác giữa protein hiển thị và các phân tử khác. Bằng cách này, các dữ liệu lớn của protein có thể được sàng lọc và khuếch đại trong một quá trình được gọi là chọn lọc trong ống nghiệm, tương tự như chọn lọc tự nhiên.
Thực khuẩn thể phổ biến nhất được sử dụng trong thể hiện phage là phage dạng sợi M13 và fd filamentous phage, khuẩn thể T4, T7 và λ cũng được sử dụng.
Smith và Winter đã được trao một nửa giải thưởng Nobel hóa học 2018 vì những đóng góp của họ trong việc phát triển thể thực khuẩn.
Nguồn: nature.com