KHÁNG THỂ MỚI HỖ TRỢ CHẨN ĐOÁN ALZHEIMER
Tác giả: Lâm Trịnh Diễm Ngọc
Mentor: Võ Đức Duy, Ph.D.
Các nhà khoa học đã thiết kế một kháng thể có ái lực cao đối với các oligomer beta amyloid (Aβ) – yếu tố chính gây ra bệnh Alzheimer với hy vọng nó sẽ trở thành một công cụ chẩn đoán tiềm năng.
BỆNH HỌC
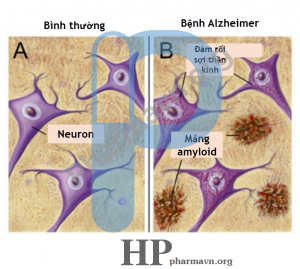
Mảng amyloid được cho là một dấu hiệu của bệnh Alzheimer. Theo giả thuyết amyloid, sự thoái hóa thần kinh là do sự chuyển đổi peptide Aβ nội sinh bình thường trong não thành các oligomer Aβ lệch cấu trúc và có tính bám dính, chúng tạo ra những mảng amyloid lớn trong neuron (tế bào thần kinh), can thiệp vào quá trình tế bào và gây chết tế bào.
TÌM RA KHÁNG THỂ HỖ TRỢ CHẨN ĐOÁN
Nhóm nghiên cứu từ Đại học Cambridge, Đại học London và Đại học Lund đã thiết kế một loại kháng thể có thể nhắm mục tiêu đến các oligomer độc hại với ái lực và độ chính xác cao và cho phép định lượng được chúng. Kết quả của họ được báo cáo trong Kỷ yếu của Viện Hàn lâm Khoa học Quốc gia (PNAS).
Nhóm nghiên cứu đã tiết lộ phương pháp của họ là nhờ vào việc tổ hợp các tương tác kháng nguyên – kháng thể bằng máy tính, từ đó thiết kế cấu trúc kháng thể phù hợp với kháng nguyên. Bằng chiến lược thiết kế nhắm mục tiêu vào epitope của các oligomer Aβ lệch cấu trúc, các nhà nghiên cứu đã thiết kế một kháng thể có ái lực với các oligomer này mạnh hơn ít nhất 1000 lần so với các peptide Aβ bình thường. Chính điều này đã tạo nên tính đặc hiệu của kháng thể, cho phép kháng thể định lượng cụ thể các oligomer trong cả mẫu in vitro và in vivo.
KẾT LUẬN
Đã có hơn 400 thử nghiệm lâm sàng về phương pháp điều trị Alzheimer, nhưng vẫn chưa có loại thuốc nào chứng minh khả năng thay đổi được tiến trình bệnh. Việc thiếu phương pháp phát hiện oligomer Aβ là một trở ngại lớn cản trở sự phát triển của chẩn đoán và can thiệp điều trị. Do đó, việc phát hiện ra một kháng thể nhắm mục tiêu chính xác các oligomer là bước ngoặt quan trọng để theo dõi tiến triển bệnh, xác định nguyên nhân của nó và cuối cùng là kiểm soát nó.
Kháng thể này đã được cấp bằng sáng chế bởi Cambridge Enterprise, chi nhánh thương mại hóa của Đại học Cambridge.
TLTK: