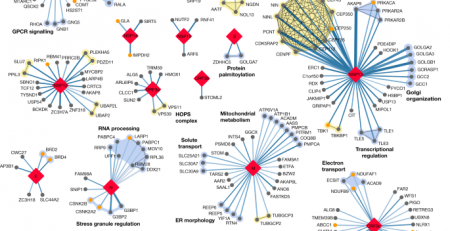
Cty Dược Vertex và CRISPR hoàn thành hồ sơ của Hoa Kỳ cho việc phê duyệt thuốc chỉnh sửa gen
Xuất bản ngày 3 tháng 4 năm 2023
Biên tập: Christopher Newman
Điểm tin tóm gọn:
- Cty Vertex Pharmaceuticals và CRISPR Therapeutics cho biết hôm thứ Hai họ đã hoàn tất việc nộp đơn xin phép Hoa Kỳ phê duyệt một loại thuốc chỉnh sửa gen cho hai chứng rối loạn máu hiếm gặp, đánh bại đối thủ cạnh tranh vì sự chậm trễ trong việc phát triển một loại thuốc điều trị tương tự.
- Cục Quản lý Thực phẩm và Dược phẩm hiện có thời hạn đến đầu tháng 6 để quyết định có chấp nhận đơn đăng ký cho thuốc của họ hay không. Loại thuốc có tên exa-cel với khả năng điều trị bệnh hồng cầu hình liềm và beta thalassemia. Nếu FDA bắt đầu xem xét “ưu tiên” hoặc cấp tốc, cơ quan này có thể đưa ra quyết định vào cuối năm nay.
- Thông tin này được đưa ra vài ngày sau khi đối thủ cạnh tranh Bluebird bio, đang phát triển một liệu pháp gen cho bệnh hồng cầu hình liềm, đã bỏ lỡ hạn nộp đơn vào cuối tháng Ba. Bluebird đang chờ phản hồi của FDA về quy trình sản xuất của mình và dự đoán sẽ nhận được phản hồi “trong vòng vài tuần”.
Đi vào chuyên sâu:
Đánh giá của FDA về exa-cel sẽ là một cột mốc quan trọng đối với y học di truyền.
Phương pháp điều trị này có thể trở thành loại thuốc đầu tiên được bán trên thị trường dựa trên CRISPR, công nghệ chỉnh sửa gen mang tính bước ngoặt đã giành giải thưởng Nobel vào năm 2020. Tháng 9 năm ngoái, FDA đã cho phép Vertex và CRISPR bắt đầu đăng ký phê duyệt sau khi thử nghiệm lâm sàng cho thấy phương pháp điều trị có thể làm giảm bớt các triệu chứng nghiêm trọng nhất của cả bệnh hồng cầu hình liềm và beta thalassemia.
Nhà phân tích Dae Gon Ha của Stifel đã viết trong một ghi chú nghiên cứu vào thứ Hai rằng liệu cơ quan quản lý có xem xét lên lịch một cuộc họp của ủy ban cố vấn để thảo luận về ứng dụng này hay không? – sẽ cung cấp một “góc nhìn của FDA về chỉnh sửa gen”.
FDA OK sẽ mang đến Hoa Kỳ một phương pháp điều trị dựa trên gen khác cho các bệnh di truyền. Năm ngoái, cơ quan quản lý đã phê duyệt ba phương pháp điều trị các bệnh về máu và não hiếm gặp, bổ sung vào các giải trước đó được rõ hơn đối với các liệu pháp gen được sử dụng để điều trị chứng mất thị lực và teo cơ cột sống. Hai loại nữa có thể sẽ sớm ra mắt, vì FDA hiện đang xem xét các loại thuốc di truyền cho bệnh loạn dưỡng cơ Duchenne và bệnh máu khó đông.
Đối với bệnh nhân hồng cầu hình liềm và beta thalassemia, exa-cel mang lại lợi ích lâu dài, nếu không nói là suốt đời. Tế bào hình liềm gây tắc nghẽn gây đau đớn và đe dọa đến tính mạng do các tế bào hồng cầu bị biến dạng, trong khi bệnh thalassemia beta cản trở sự hình thành của huyết sắc tố chức năng, một loại protein vận chuyển oxy thiết yếu.
Các bệnh nhân beta thalassemia ở Hoa Kỳ đã có sẵn một loại thuốc di truyền, liệu pháp gen Zynteglo của Bluebird, được FDA chấp thuận vào năm ngoái. Bệnh nhân hồng cầu hình liềm thì chưa, nhưng điều đó có thể sớm thay đổi với việc xem xét exa-cel và trong tương lai gần có thể cả phương pháp điều trị của Bluebird.
Việc hoàn thành ứng dụng thuốc trên của Vertex và CRISPR đưa các công ty này đi trước Bluebird một bước ở Hoa Kỳ. Họ cũng đã hoàn thành các ứng dụng ở Châu Âu và Vương quốc Anh.
Biên dịch: Th.S Trương Hoàng Thiện.
Hiệu đính: DS. Trần Thị Quốc Tuyến (PharmD).
Nguồn bài viết, ảnh: