Xét nghiệm sinh học đáp ứng miễn dịch ở bệnh nhân Covid-19
Biên dịch: Lâm Trịnh Diễm Ngọc, Phạm Duy Tú Anh, Nguyễn Thị Duyên
Mentor: Võ Đức Duy, Ph.D.
COVID-19 đã trở thành một cuộc khủng hoảng toàn cầu nhưng vẫn còn tồn tại những lỗ hổng kiến thức lớn về khả năng miễn dịch của con người đối với virus SARS-CoV-2. Do đó, một nghiên cứu đã được tiến hành trên 2 nhóm đối tượng đến từ Hồng Kông và Atlanta nhằm làm sáng tỏ cơ chế hệ miễn dịch đáp ứng với SARS-CoV-2, từ đó định hướng mục tiêu điều trị tiềm năng cho bệnh nhân mắc COVID-19 [1]. Hệ thống các xét nghiệm sinh học được thực hiện trong nghiên cứu gồm có:
- Phân tích mẫu bạch cầu máu ngoại vi
- Đánh giá chức năng các tế bào tủy tạo máu và tế bào đuôi gai plasmacytoid
- Đo nồng độ huyết tương của các cytokine và chất trung gian gây viêm
- Phản ứng phiên mã đơn bào và phân tích CITE-seq
- Đánh giá mối tương quan giữa mức độ nhiễm COVID-19 với sự giải phóng chất tế bào vi khuẩn
I ĐỐI TƯỢNG
Các đối tượng tham gia nghiên cứu được chia làm ba nhóm: nhóm nhiễm COVID-19 (n=76); nhóm nhiễm virus cúm/RSV (n=16) và nhóm khỏe mạnh (n=69); tuổi từ 18 đến 94. Nhóm nhiễm COVID-19 gồm các bệnh nhân nhiễm COVID-19 ở cả 3 mức độ: nhẹ/trung bình, nặng và ICU.
II KẾT QUẢ
- Phân tích mẫu bạch cầu máu ngoại vi bằng phương pháp đo tế bào khối
Phương pháp đo tế bào khối (CyTOF) là một biến thể của phương pháp đo tế bào dòng chảy trong đó các kháng thể được đánh dấu bằng ion kim loại nặng chứ không phải huỳnh quang [2].
Để mô tả chính xác kiểu hình tế bào miễn dịch trong hệ tế bào máu đơn nhân ngoại vi (PBMCs), các nhà khoa học đã sử dụng bảng điều khiển phospho-CyTOF bao gồm 22 điểm đánh dấu (marker) trên bề mặt tế bào và 12 điểm được dánh dấu trong nội bào (bảng S1). Thí nghiệm được thiết kế như hình 1A.
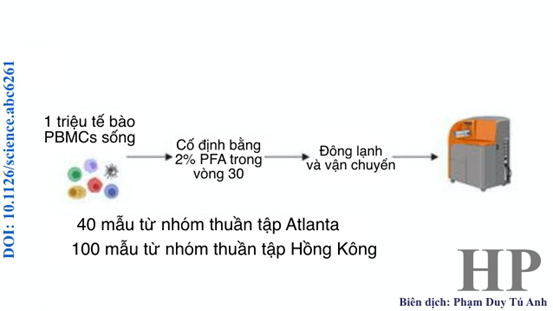
Hình 1A. Thiết kế thí nghiệm xác định kiểu hình tế bào miễn dịch trong PBMCs
Chú thích:
- phospho-CyTOF: nhuộm các phân tử được phosphoryl hóa để đo tế bào khối

Thiết bị này đã xác định được 12 kiểu hình con chính của tế bào miễn dịch ở cả hai nhóm thuần tập, trong đó có sự gia tăng đáng kể các tế bào miễn dịch trong nguyên tương bào (plasmablast) và tế bào thực thi TCD8 (effector) trong tất cả các cá thể bị nhiễm bệnh ở cả 2 nhóm (hình 1B). Điều đáng chú ý là các phản ứng động học của tế bào thực thi TCD8 kéo dài và tiếp tục tăng lên đến ngày thứ 40 sau khi khởi phát các triệu chứng (hình 1C).

Hình 1B. Xác định 12 kiểu hình con chính của tế bào miễn dịch

Hình 1C. Phản ứng động học của các tế bào miễn dịch
Ngoài ra, bằng phương pháp đo thủ công (phương pháp nuôi cấy), nhóm nghiên cứu đã xác định được 25 nhóm tế bào con miễn dịch khác nhau, trong đó tần suất các tế bào đuôi gai plasmacytoid (pDC) đã giảm đi đáng kể trong PBMC ở những bệnh nhân nhiễm Covid-19 của cả 2 nhóm thuần tập (hình 1D).
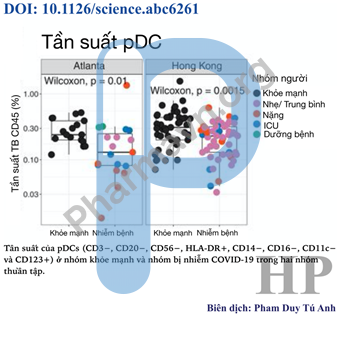
Hình 1D. Tần suất pDC giảm đáng kể ở những bệnh nhân nhiễm Covid-19
Theo hình 1C, phản ứng động học của pDC không thấy rõ mối liên hệ với thời gian kể từ khi khởi phát triệu chứng cũng không tương quan với mức độ nghiêm trọng lâm sàng.
Xuất hiện sự giảm biểu hiện của pS6 ở pDCs và sự giảm nồng độ IKBα ở các tế bào đuôi gai dòng tủy (mDC) cho thấy sự suy giảm khả năng sản xuất IFN-α ở bệnh nhân COVID-19 (hình 1E).

Hình 1E. Sự giảm biểu hiện pS6 ở pDCs và giảm nồng độ IKBα ở mDC
Chú thích:
- pS6 (phosphorylated ribosomal protein S6): Một loại protein mục tiêu chính nhằm kích hoạt Rapamycin (mTOR).
- IKB-α: Chất ức chế tín hiệu yếu tố phiên mã NF-κB.
Các nhà khoa học đã ứng dụng mô hình hóa tuyến tính các dữ liệu nhằm phát hiện các đặc điểm phân biệt giữa những người khỏe mạnh và người nhiễm bệnh cũng như người có cùng triệu chứng điển hình bệnh COVID-19 trên hai nhóm thuần tập ban đầu. Tuy nhiên, không có đặc điểm nào quá khác biệt giữa các nhóm về mức độ nghiêm trọng mặt lâm sàng của bệnh (hình 1F).

Hình 1F. Các đặc điểm phân biệt người khỏe mạnh và người nhiễm COVID-19 thông qua mô hình hóa tuyến tính dữ liệu
- Đánh giá chức năng các tế bào tủy tạo máu và tế bào đuôi gai plasmacytoid (pDC)
Các nhà nghiên cứu đã thực hiện kích thích ngoại vi đối với PBMCs ở những cá thể khỏe mạnh hoặc bị nhiễm COVID-19 bằng một hỗn hợp được tổng hợp từ thụ thể giống Toll (TLR) 7/8 và 3 phối tử (TLR-3, polyIC và R848) được biểu hiện bởi virus; sau đó thực hiện xét nghiệm nội bào nhuộm hỗn hợp trên và đánh giá các phản ứng của cytokines.
Kết quả: Tế bào pDC giảm sản xuất IFN-α và giảm đáng kể phản ứng TNF-α ở bệnh nhân nhiễm COVID-19 (hình 2A). Phản ứng của các tế bào dòng tủy đuôi gai plasmacytoid (mDCs) và bạch cầu đơn nhân CD14+ thấp hơn đáng kể khi kích thích với một loại phối tử vi khuẩn (TLR-2, -4, -5) hoặc TLR cocktail của virus (hình 2B, 2D). Mức IKBα giảm đã không làm tăng cường sự phosphoryl hóa của NF-κβ p65 như được đo ở p65 (Ser 529) trong cùng ô (hình 2C).
Như vậy, COVID-19 gây suy giảm chức năng các tế bào tủy tạo máu cũng như các tế bào đuôi gai plasmacytoid.

Hình 2A-C. Đánh giá chức năng các tế bào pDC và mDC

Hình 2D. Đánh giá chức năng tế bào bạch cầu đơn nhân CD14+
- Đo nồng độ huyết tương của các cytokine và chất trung gian gây viêm
Nhiễm COVID-19 gây ra một phản ứng viêm đặc trưng bởi các cytokine được giải phóng từ các mô, rất có thể là phổi, dẫn đến gia tăng nồng độ huyết tương các cytokine này và ức chế hệ thống miễn dịch bẩm sinh ở ngoại vi. Đồng thời, có sự gia tăng đáng kể nồng độ huyết tương của 3 protein TNFSF14, EN-RAGE và oncostatin-M; sự gia tăng này có tương quan chặt chẽ với mức độ nghiêm trọng lâm sàng (hình 3).

Hình 3. Sự gia tăng nồng độ huyết tương các cytokine và chất trung gian gây viêm
- Phản ứng phiên mã đơn bào và phân tích CITE-seq
Thí nghiệm được chia thành 2 đợt, được bố trí như hình 4A và thu được transcriptome (bản phiên mã hoàn chỉnh của toàn bộ RNA) của 63.000 tế bào. Tập dữ liệu cuối cùng bao gồm 57.669 transcriptomes chất lượng cao với xấp xỉ 4.78 tế bào / mẫu và 1.803 gen / tế bào.
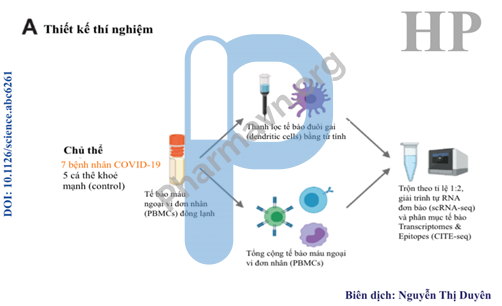
Hình 4A. Thiết kế thí nghiệm giải trình tự phiên mã đơn bào
Kết quả: Gen mã hóa interferon loại I, gen mã hóa cytokine gây viêm trong PBMC biểu hiện thấp nhưng có sự biểu hiện tăng cường của gen kích thích interferon (ISG) ở bệnh nhân COVID-19 (hình 4B – 4H).
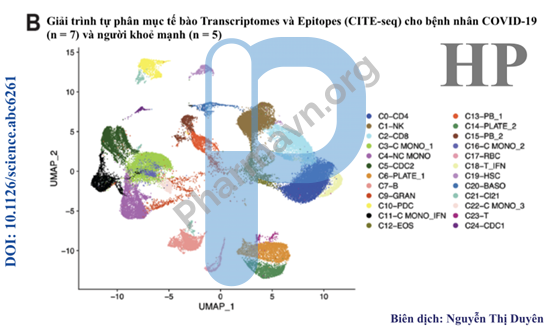
Hình 4B. Phép chiếu xấp xỉ và thống nhất (UMAP) của tế bào máu ngoại vi đơn nhân (PBMCs) từ các mẫu phân tích (n = 12)
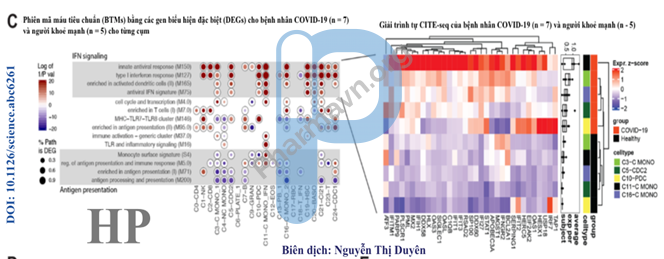
Hình 4C. Mô tả trạng thái phiên mã độc nhất của các tế bào đơn lẻ từ các cá thể nhiễm COVID-19 so sánh với người khoẻ mạnh. Phân tích cho thấy sự tăng lên rõ rệt của các phiên mã máu tiêu chuẩn (BTM) kháng virus, đặc biệt ở dòng tế bào tuỷ và tế bào đuôi gai.
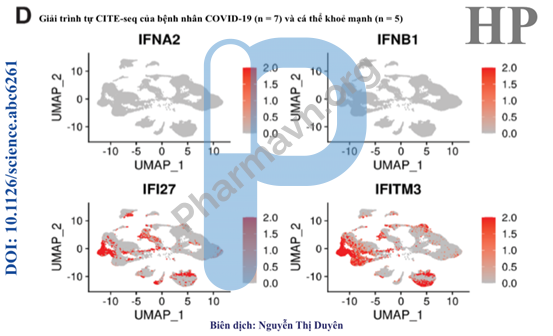
Hình 4D. Có sự biểu hiện tăng cường của gen kích thích interferon (ISG) ở bệnh nhân COVID-19, mặc dù khả năng sản xuất cytokine của tế bào bẩm sinh trong máu bị suy giảm.
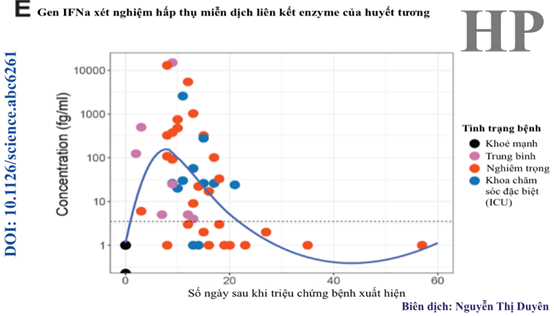
Hình 4E. Nồng độ gen IFN-α gia tăng đáng kể đỉnh điểm vào ngày thứ 8 sau khi các triệu chứng xuất hiện và thoái lui về mức ban đầu vào ngày thứ 20.
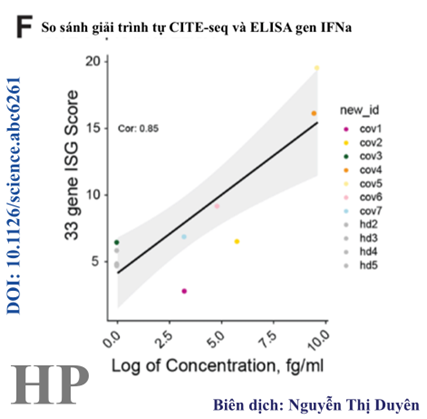
Hình 4F. Có mối tương quan chặt chẽ giữa mức độ biểu hiện trung bình của ISG trong PBMC bằng cách phân tích giải trình tự CITE-seq và xác định nồng độ gen IFN-α trong huyết tương. Phản ứng gen IFN-α phụ thuộc vào thời gian.

Hình 4G. ISG ở bệnh nhân COVID-19 tăng mạnh so với các cá thể khoẻ mạnh. Bản đồ nhiệt phân cụm theo thứ bậc về biểu hiện ISG trong bộ dữ liệu giải mã RNA (RNA-seq) số lượng lớn.
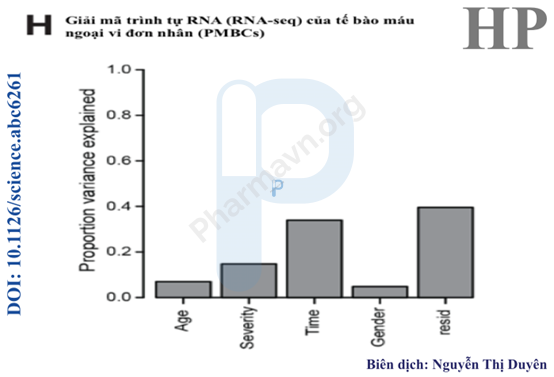
Hình 4H: Phân tích tác động riêng lẻ của thời gian, mức độ bệnh, giới tính và tuổi tác lên ISG. Thời gian là yếu tố chính trong việc biểu hiện ISG, tình trạng bệnh lâm sàng cũng có tác động đáng kể.
Tổng hợp lại, những dữ liệu này chứng minh rằng trong thời kỳ ủ bệnh, mức độ lưu thông thấp của IFN-α đã kích thích tăng cường mức biểu hiện của gen ISG ngoại vi. Còn các tế bào miễn dịch bẩm sinh ở ngoại vi thì bị suy giảm khả năng sản xuất cytokine gây viêm, tuy nhiên các cytokine lại được tăng cường phóng thích bởi mô phổi nên nồng độ cytokine huyết tương vẫn tăng cao (như đã trình bày ở mục 3).
- Đánh giá mối tương quan giữa mức độ nhiễm COVID-19 nghiêm trọng với sự giải phóng chất tế bào vi khuẩn
Mức độ gia tăng của các chất trung gian tiền viêm trong huyết tương bao gồm IL-6, TNF, TNFSF14, EN-RAGE và OSM, cùng với các phản ứng miễn dịch bẩm sinh bị ức chế trong các tế bào bạch cầu đơn nhân gây ra tình trạng lâm sàng giống như nhiễm trùng huyết.
Huyết tương của bệnh nhân nặng và bệnh nhân ICU có nồng độ DNA vi khuẩn cao hơn đáng kể. Hơn nữa, có một mối tương quan đáng kể giữa DNA hoặc LPS của vi khuẩn và nồng độ trong huyết tương của các chất trung gian gây viêm IL-6, TNF, MCP-3, EN-RAGE, TNFSF14 và OSM. Những kết quả này cho thấy sự giải phóng cytokine tăng cường một phần là do các sản phẩm vi khuẩn gia tăng trong phổi hoặc trong các mô khác.
III BÀN LUẬN
Sự gia tăng đáng kể và kéo dài của các tế bào bạch cầu và tế bào thực thi TCD8 trong máu ngoại vi phù hợp với các nghiên cứu gần đây. Đáng chú ý, các tế bào này tiếp tục tăng lên đến ngày thứ 40 sau khi bắt đầu có triệu chứng. Các nghiên cứu đã chỉ ra rằng nhiễm trùng SARS-CoV-2 gây ra tình trạng kiệt sức và apoptosis ở tế bào T. Những câu hỏi như “Đáp ứng gia tăng số lượng kéo dài của tế bào TCD8 có phản ánh việc tiếp xúc liên tục với kháng nguyên hay không?” và “Liệu tế bào có cạn kiệt hay không?” cần nghiên cứu thêm.
Nồng độ cytokine huyết tương tăng cao có thể bắt nguồn từ các tế bào trong mô phổi hơn là từ các tế bào máu ngoại vi. Dữ liệu cytokine huyết tương có thể được sử dụng để xây dựng hồ sơ miễn dịch học phân biệt giữa bệnh COVID-19 nặng và trung bình.
Các phân tử như EN-RAGE hoặc TNFSF14 và các thụ thể của chúng, có thể đại diện cho mục tiêu điều trị hấp dẫn chống lại COVID-19.
IV ỨNG DỤNG CAN THIỆP ĐIỀU TRỊ
Trong nghiên cứu này, các nhà khoa học đã xem xét thêm về tính ảnh hưởng khác nhau của việc can thiệp trong điều trị bằng IFN-β1 (một loại protein thuộc nhóm Interferon I), corticosteroid và thuốc kháng virus đối với đáp ứng miễn dịch ở bệnh nhân COVID-19. Kết quả cho thấy tần suất TCD8 ở nhóm plasmablast và các tế bào thực thi tăng lên so với nhóm chứng khỏe mạnh ở bất kì can thiệp và cá thể nhiễm bệnh nào trong nhóm bệnh (hình 5). Có sự gia tăng tần suất tế bào thực thi TCD8 và sự giảm tín hiệu ps6 trong pDC khi được điều trị bằng thuốc kháng virus (hình 6).
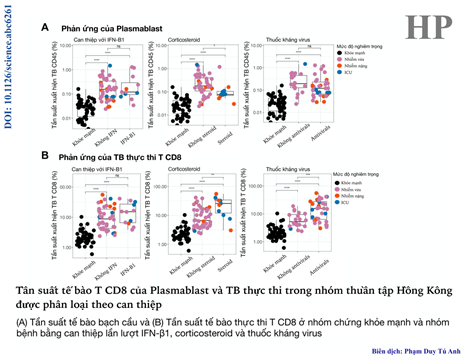
Hình 5. Tần suất TCD8 ở plasmablast và tế bào thực thi tăng lên ở cả ba nhóm can thiệp
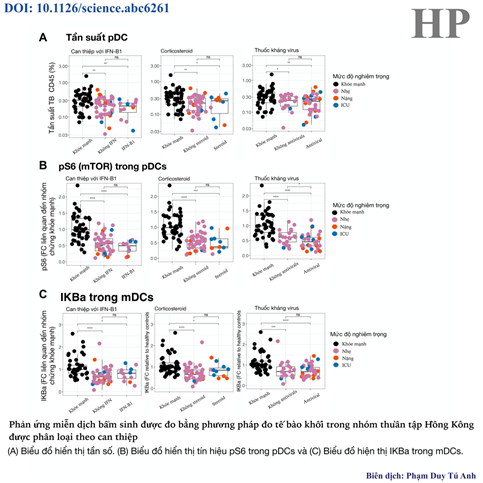
Hình 6. Tần suất tế bào thực thi TCD8 tăng và tín hiệu ps6 giảm ở nhóm can thiệp bằng thuốc kháng virus
Ngoài ra, theo kết quả mục 1,2 và 4, COVID-19 gây suy giảm đáp ứng IFN loại I ở ngoại vi. Do đó, tiêm IFN loại I đã được đề xuất như một chiến lược để can thiệp điều trị COVID-19.
Có giả thiết cho rằng điều trị dự phòng với IFN-I trước phơi nhiễm sẽ hiệu quả hơn điều trị sau. Kiến thức thu được trong quá trình nghiên cứu về MERS-CoV hoặc SARS-CoV chỉ ra rằng và IFN-I nên được sử dụng càng sớm càng tốt để tối ưu hóa điều trị, tránh các tác dụng phụ và IFN-β là loại phù hợp nhất [3].
Ở Trung Quốc, các hướng dẫn điều trị COVID-19 khuyến nghị sử dụng IFN-α 5 triệu U bằng cách hít hơi hai lần một ngày cho bệnh nhân, kết hợp với ribavirin [4]. Việc đưa thuốc vào cơ thể bằng cách hít hơi hiện đang được thực hiện ở Trung Quốc mang lại lợi ích là nhắm mục tiêu cụ thể vào đường hô hấp; tuy nhiên dược lực học và dược động học của đường dùng này chưa được đánh giá. Ngược lại, các phương thức tiêm tĩnh mạch và tiêm dưới da đã được mô tả tốt, được chứng minh về mặt dược lực học, dược động học và tính an toàn trong một số thử nghiệm lâm sàng.
Sự kết hợp IFN-I với lopinavir/ritonavir, ribavirin hoặc remdesivir có thể tăng cường hiệu quả của nó trên các chủng virus Corona, điều này đã được quan sát in vitro [5].
Kết luận, tiêm Interferon I (IFN-I) có thể là giải pháp điều trị an toàn và dễ dàng chống lại COVID-19 trong giai đoạn đầu của bệnh. Việc thiếu mô hình động vật hiện tại đối với COVID-19 không nên ngăn cản việc đánh giá lâm sàng phương pháp điều trị này, vì tính an toàn của nó đã được đánh giá trong nhiều thử nghiệm lâm sàng độc lập. Tuy nhiên, cần lưu ý rằng tín hiệu IFN-β1 đã được chứng minh là làm tăng biểu hiện ACE2 trong tế bào phổi, có thể dẫn đến tăng nguy cơ nhiễm trùng [6].
TLTK:
- https://science.sciencemag.org/content/369/6508/1210?fbclid=IwAR2emyrcyeIABnK8k8VA39PJsm2PHFmwKDDdpsxTz0UM37a996GhnZ2FMBM
- https://iti.stanford.edu/himc/mass-cytometry.html
- https://pubmed.ncbi.nlm.nih.gov/31355779/
- https://pubmed.ncbi.nlm.nih.gov/32147628/
- https://pubmed.ncbi.nlm.nih.gov/31924756/
- https://pubmed.ncbi.nlm.nih.gov/32413319/